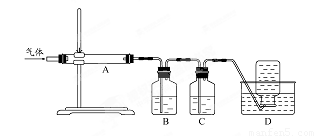
题目内容
氧化镁主要用于制备陶瓷和耐火材料,医药上可用作抗酸剂.以卤水(主要含Mg2+Na+、Cl-、S
)为原料制取高纯氧化镁的工艺流程如图所示:
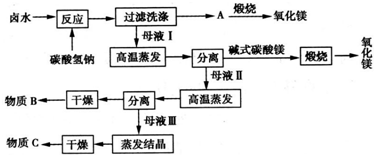
(1)反应温度对产品质量的影响情况如表所示:
由此可知,煅烧A生成MgO最适宜的温度为
(2)的主要成分是
(3)物质B和C的主要成分分别是
(4)写出碱式碳酸镁高温分解生成MgO的化学反应方程式:
| O | 2- 4 |

(1)反应温度对产品质量的影响情况如表所示:
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| MgO的质量分数/% | 97.75 | 97.56 | 97.86 | 99.13 | 99.01 |
60℃
60℃
,原因是该温度下产品中氧化镁质量分数相对较高
该温度下产品中氧化镁质量分数相对较高
(2)的主要成分是
MgCO3
MgCO3
(填化学式),确定A已洗涤干净的操作和现象是取最后一次的洗涤液,加入少量盐酸酸化的氯化钡溶液,若无沉淀产生,证明已经洗涤干净
取最后一次的洗涤液,加入少量盐酸酸化的氯化钡溶液,若无沉淀产生,证明已经洗涤干净
(3)物质B和C的主要成分分别是
硫酸钠、氯化钠
硫酸钠、氯化钠
(两者均写名称).(4)写出碱式碳酸镁高温分解生成MgO的化学反应方程式:
Mg2(OH)2CO3
2MgO+CO2↑+H2O↑
| ||
Mg2(OH)2CO3
2MgO+CO2↑+H2O↑
.
| ||
分析:(1)根据温度和氧化镁质量分数之间的关系来回答;
(2)煅烧碱式碳酸镁可以得到氧化镁,碳酸镁可以和盐酸反应生成氯化镁和水以及二氧化碳,如果碳酸镁洗涤不干净会占有硫酸盐,可以检验硫酸根是否存在;
(3)根据硫酸钠以及氯化钠溶解度知识来回答判断;
(4)碱式碳酸镁高温下分解为氧化镁、水以及二氧化碳.
(2)煅烧碱式碳酸镁可以得到氧化镁,碳酸镁可以和盐酸反应生成氯化镁和水以及二氧化碳,如果碳酸镁洗涤不干净会占有硫酸盐,可以检验硫酸根是否存在;
(3)根据硫酸钠以及氯化钠溶解度知识来回答判断;
(4)碱式碳酸镁高温下分解为氧化镁、水以及二氧化碳.
解答:解:(1)根据表中数据可以知道,产品中氧化镁质量分数相对较高的温度是60℃,所以煅烧A生成MgO最适宜的温度为60℃,故答案为:60℃;
(2)加入碳酸氢钠之后,过滤得到的沉淀物是碳酸镁,再煅烧可以得到氧化镁,溶液中含有的离子是钠离子、氯离子、硫酸根离子等,所以判断是否洗涤干净,可以检验硫酸根离子是否存在,即取最后一次的洗涤液,加入少量盐酸酸化的氯化钡溶液,若无沉淀产生,证明已经洗涤干净,
故答案为:MgCO3;取最后一次的洗涤液,加入少量盐酸酸化的氯化钡溶液,若无沉淀产生,证明已经洗涤干净;
(3)硫酸钠的溶解度随着温度变化比较大,而氯化钠的溶解度随着温度变化比较小,因而应该是先析出硫酸钠,再蒸发结晶可以得到氯化钠,
故答案为:硫酸钠、氯化钠;
(4)碱式碳酸镁高温下分解为氧化镁、水以及二氧化碳,方程式为:Mg2(OH)2CO3
2MgO+CO2↑+H2O↑,
故答案为:Mg2(OH)2CO3
2MgO+CO2↑+H2O↑.
(2)加入碳酸氢钠之后,过滤得到的沉淀物是碳酸镁,再煅烧可以得到氧化镁,溶液中含有的离子是钠离子、氯离子、硫酸根离子等,所以判断是否洗涤干净,可以检验硫酸根离子是否存在,即取最后一次的洗涤液,加入少量盐酸酸化的氯化钡溶液,若无沉淀产生,证明已经洗涤干净,
故答案为:MgCO3;取最后一次的洗涤液,加入少量盐酸酸化的氯化钡溶液,若无沉淀产生,证明已经洗涤干净;
(3)硫酸钠的溶解度随着温度变化比较大,而氯化钠的溶解度随着温度变化比较小,因而应该是先析出硫酸钠,再蒸发结晶可以得到氯化钠,
故答案为:硫酸钠、氯化钠;
(4)碱式碳酸镁高温下分解为氧化镁、水以及二氧化碳,方程式为:Mg2(OH)2CO3
| ||
故答案为:Mg2(OH)2CO3
| ||
点评:本题是一道关于物质的分离以及提纯知识的化学实验方案设计题,考查学生分析和解决问题的能力,难度不大.

练习册系列答案
相关题目

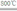 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑