题目内容
【题目】某研究性学习小组欲用化学方法测量一个不规则的容器的体积,取14.3g Na2CO310H2O放入100mL烧杯中,加入50mL水配成溶液,将溶液转移到该容器中,用蒸馏水稀释到完全充满该容器,从中取出10mL该溶液,然后逐滴滴入质量分数为3.65%(密度为1g/cm3)的稀盐酸直至没有气体放出为止,用去该稀盐酸10mL.求:
(1)该容器的容积.
(2)所得CO2在标况下的体积.
【答案】
(1)解:盐酸的物质的量浓度= ![]() mol/L=1mol/L,参加反应HCl的物质的量=0.01L×1mol/L=0.01mol,
mol/L=1mol/L,参加反应HCl的物质的量=0.01L×1mol/L=0.01mol,
由Na2CO3+2HCl=2NaCl+CO2↑+H2O,可知10mL溶液中碳酸钠的物质的量=0.01mol× ![]() =0.005mol,碳酸钠溶液的物质的量浓度为
=0.005mol,碳酸钠溶液的物质的量浓度为 ![]() =0.5mol/L,碳酸钠晶体的物质的量=
=0.5mol/L,碳酸钠晶体的物质的量= ![]() =0.05mol,则碳酸钠溶液体积=
=0.05mol,则碳酸钠溶液体积= ![]() =0.1L=100mL,故容器的容积为100mL,
=0.1L=100mL,故容器的容积为100mL,
答:该容器的容积为100mL
(2)解:由Na2CO3+2HCl=2NaCl+CO2↑+H2O,可知生成二氧化碳的物质的量=0.01mol× ![]() =0.005mol,标况下二氧化碳的体积为0.005mol×22.4L/mol=0.112L,
=0.005mol,标况下二氧化碳的体积为0.005mol×22.4L/mol=0.112L,
答:标况下生成二氧化碳为0.112L
【解析】(1)盐酸与碳酸钠发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据c= ![]() 计算盐酸的物质的量浓度,根据n=cV计算参加反应HCl的物质的量,根据方程式计算10mL溶液中碳酸钠的物质的量,进而计算碳酸钠溶液的物质的量浓度,根据n=
计算盐酸的物质的量浓度,根据n=cV计算参加反应HCl的物质的量,根据方程式计算10mL溶液中碳酸钠的物质的量,进而计算碳酸钠溶液的物质的量浓度,根据n= ![]() 计算碳酸钠晶体的物质的量,再根据V=
计算碳酸钠晶体的物质的量,再根据V= ![]() 计算溶液体积,即为容器的容积;(2)根据方程式计算生成二氧化碳的物质的量,再根据V=nVm计算二氧化碳的体积.
计算溶液体积,即为容器的容积;(2)根据方程式计算生成二氧化碳的物质的量,再根据V=nVm计算二氧化碳的体积.

【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
【题目】氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取。反应原理、实验装置图(加热装置都已略去)如下:
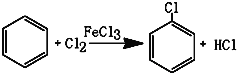
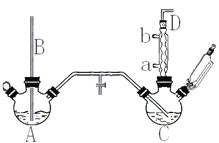
已知:氯苯为无色液体,沸点132.2℃,常温下不与氢氧化钠溶液反应。
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是______________________。 冷凝管中冷水应从____________(填“a”或“b”)处通入。
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40℃~60℃为宜,温度过高会生成二氯苯。
①对C加热的方法是___________(填序号)。
A.酒精灯加热 B.酒精喷灯加热 C.水浴加热
②D出口的气体成分有HCl、Cl2和_________。
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本。写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:__________________;______________________(写两个即可)。
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是___________。
(5)工业生产中苯的流失情况如下:
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
则1t苯可制得成品为____________________t(只要求列式)。