题目内容
如图所示,在元素周期表中处于A、B位置的某些元素性质相似,这称为“对角线规则”。下列有关4号元素铍的性质的推断正确的是( )
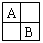
A.铍能与冷水发生剧烈反应
B.氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应
C.氢氧化铍的化学式为Be(OH)3
D.氧化铍只溶于强酸溶液,不溶于强碱溶液
【答案】
B
【解析】在元素周期表中,铍位于铝的左上方,根据“对角线规则”,铍和铝的化学性质相似

练习册系列答案
相关题目
X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A、Y元素最高价氧化物对应的水化物化学式为H3YO4 |
| B、Y最简单气态氢化物的水溶液显弱碱性 |
| C、原子半径由小到大的顺序为:X<Z<Y<W |
| D、X、Z两种元素的氧化物中所含化学键类型相同 |
[物质结构与性质]
(1)A、B、C为短周期元素,请根据下表信息回答问题.
①第一电离能:A B(填“>”、“<”或“=”),基态C原子的电子排布式为 .
②B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为 .
(2)发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目取得积极进展.已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇(CH3OH)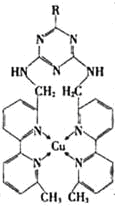 ,从而实现液化.
,从而实现液化.
①某含铜的离子结构如图所示,在该离子内部微粒间作用力的类型有 .
a.离子键 b.极性键 c.非极性键 d.配位键 e.范德华力 f.氢键) (填字母)
②煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛(HCHO),甲醇的沸点64.96℃,甲醛的沸点-21℃,甲醇的沸点更高的原因是因为分子间存在着氢键,甲醛分子间没有氢键,但是甲醇和甲醛均易溶于水,原因是它们均可以和水分子间形成氢键.请你说明甲醛分子间没有氢键原因 ;
③甲醇分子中进行sp3杂化的原子有 ;甲醛与H2发生加成反应,当生成1mol甲醇,断裂σ键的数目为 .
(1)A、B、C为短周期元素,请根据下表信息回答问题.
| 元素 | A | B | C |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物的水溶液显碱性 | 原子有三个电子层,简单离子在本周期中半径最小 |
②B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为
(2)发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目取得积极进展.已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇(CH3OH)
 ,从而实现液化.
,从而实现液化.①某含铜的离子结构如图所示,在该离子内部微粒间作用力的类型有
a.离子键 b.极性键 c.非极性键 d.配位键 e.范德华力 f.氢键) (填字母)
②煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛(HCHO),甲醇的沸点64.96℃,甲醛的沸点-21℃,甲醇的沸点更高的原因是因为分子间存在着氢键,甲醛分子间没有氢键,但是甲醇和甲醛均易溶于水,原因是它们均可以和水分子间形成氢键.请你说明甲醛分子间没有氢键原因
③甲醇分子中进行sp3杂化的原子有
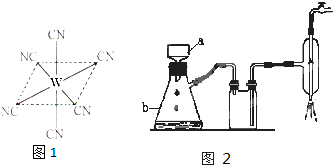
 短周期元素M、X、Y、Z,其中X、Y、Z在周期表中所处的位置如图所示.M元素原子的最外层电子数为其次外层电子数的2倍.X、Y、Z三种元素原子质子数之和为32.则下列说法正确的是( )
短周期元素M、X、Y、Z,其中X、Y、Z在周期表中所处的位置如图所示.M元素原子的最外层电子数为其次外层电子数的2倍.X、Y、Z三种元素原子质子数之和为32.则下列说法正确的是( )