题目内容
11分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极。
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)电极b上发生的电极反应为___________________________________。
(2)电极b上生成的气体在标状况下的体积为__________________,此时甲烧杯中NaOH溶液的物质的量浓度为(设溶液的密度为1g/cm3)_______________。
(3)电极c的质量变化是___________g,欲使电解后乙中的电解液恢复到起 始状态,应该向溶液中加入适量的___________(填字母编号)。
始状态,应该向溶液中加入适量的___________(填字母编号)。
| A.Cu(OH)2 | B.Cu2O | C.CuCO3 | D. Cu2(OH)2CO3 Cu2(OH)2CO3 |
(1)4OH--4e-=2H2O + O2↑(2分) (2)5.6 L(2分) 1.5mol/L(2分)
(3) 32(2分) C(1分) (4) 精铜或纯铜(1分) 粗铜(1分)
解析

实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的物理性质如下表。请回答有关问题。
|
化合物 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100 g水 |
|
正丁醇 |
0.810 |
118.0 |
9 |
|
冰醋酸 |
1.049 |
118.1 |
∞ |
|
乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入11.5 mL正丁醇和9.4 mL冰醋酸,再加3~4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应。
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式:______________、______________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是________________、________________。
Ⅱ.乙酸正丁酯精产品的制备
(1)将乙酸正丁酯粗产品用如下操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠溶液洗涤,正确的操作步骤是__________(填字母)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
(2)将酯层采用如下图所示装置蒸馏。
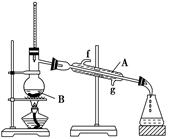
①写出上图中仪器A的名称______________,冷却水从__________口进入(填字母)。
②蒸馏收集乙酸正丁酯产品时,应将温度控制在__________左右。
Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成水的体积为1.8 mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率为__________。


