题目内容
(11分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了下图所示装置进行有
关实验:
(1)先关闭活塞a,将6.4 g铜片和12 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失.
①写出上述过程中烧瓶内发生反应的化学方程式:
打开活塞a之前 ;
打开活塞a之后 。
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整。
(2)实际上,在打开活塞a之前硫酸仍有剩余。为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量。他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况)。你认为甲学生设计的实验方案中D装置中试剂为: (填化学式)。
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100 mL溶液,再取20 mL于锥形瓶中,用 作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为 ,再求出余酸的物质的量,若耗去a mol/L氢氧化钠溶液b mL,则原余酸的物质的量为 mol(用含a、b的表达式来表示)。
(1)①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 2Cu+2H2SO4+O2===2CuSO4+2H2O
②B装置中导管长进短出
(2)①饱和NaHSO3 ②甲基橙
因为Cu(OH)2开始沉淀的pH约为5,若用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,Cu(OH)2的蓝色会干扰滴定终点的正确判断
解析试题分析:(1)①打开活塞a之前发生的是铜和浓硫酸的反应,方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,随着反应进行硫酸浓度变小,反应停止发生,打开活塞a后氧气进入,在酸性条件下反应生成硫酸铜,方程式为:2Cu+2H2SO4+O2===2CuSO4+2H2O。②收集的是SO2气体,密度比空气大,所以应该用向上排空气法,因此B中导管是长进短出。
(2)①SO2在NaHSO3溶液中的溶解度最小所以D装置中的试剂应该是NaHSO3溶液。
②用NaOH滴定反应后的溶液时,由于溶液中有Cu2+所以不能让Cu2+沉淀干扰滴定终点的判断,因此pH应该控制在5之内,因此选用甲基橙做指示剂。滴定中用掉a mol/L氢氧化钠溶液b mL,则原剩余的硫酸为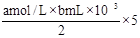 =。
=。
考点:铜与浓硫酸反应
点评:本题综合性强,主要考查学生分析问题的能力,尤其在选择指示剂的时候,要注意考虑到Cu2+会发生反应。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案(11分)某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。

已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H ②有关有机物的沸点:
|
试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
|
沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用是 ;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式: 。
(2)球形干燥管C的作用是 。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示) ;反应结束后D中的现象是 .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 (填物质名称);再加入(此空从下列选项中选择,填编号) ,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
 (2012?江苏一模)在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
(2012?江苏一模)在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.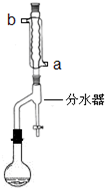 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.