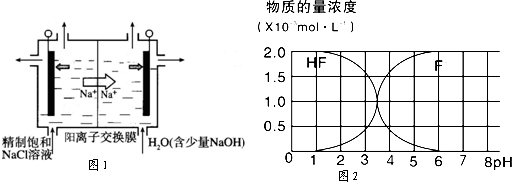
题目内容
二氧化氯(ClO2)是一种新型自来水消毒剂.下列有关二氧化氯说法错误的是( )
分析:A、由二氧化氯(Cl02)可知该物质的元素的组成;
B、相对分子质量,即各种元素的相对原子质量和的总和;
C、氧化物由两种元素组成,其中一种为氧元素;
D、元素的质量比为各种元素的相对原子质量和的比.
B、相对分子质量,即各种元素的相对原子质量和的总和;
C、氧化物由两种元素组成,其中一种为氧元素;
D、元素的质量比为各种元素的相对原子质量和的比.
解答:解:由二氧化氯(Cl02)具体分析如下:
A、可知由氯元素和氧元素组成,故A正确;
B、相对分子质量=35.5+16×2=67.5,故B正确;
C、是一种氧化物,它由氯元素和氧元素组成,故C正确;
D、氯氧两元素的质量比=35.5:(16×2)=35.5:32,而1:2为原子个数比,故D错误.
故选D.
A、可知由氯元素和氧元素组成,故A正确;
B、相对分子质量=35.5+16×2=67.5,故B正确;
C、是一种氧化物,它由氯元素和氧元素组成,故C正确;
D、氯氧两元素的质量比=35.5:(16×2)=35.5:32,而1:2为原子个数比,故D错误.
故选D.
点评:要求学生了解化学式的书写及其意义,从组成上识别氧化物,并了解有关化学式的计算和推断方法及其技巧.

练习册系列答案
相关题目
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.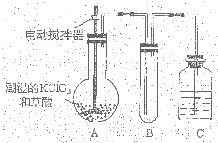 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题: