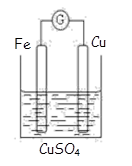
题目内容
CuI是一种不溶于水的白色固体,可以由反应2Cu2++4I-=2CuI↓+I2得到.现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液.下列叙述正确的是( )
分析:石墨为阴极,以Cu为阳极电解KI溶液,通电后,溶液中的H+、K+移向阴极,而H+的氧化性强于K+,所以H+得电子被还原,电极反应式为2H2O++2e-=H2↑+2OH-,破坏了水的电离平衡,使c(OH-)>c(H+),酚酞试液变红;
I-和OH-移向阳极,而失电子能力Cu>I->OH-,故Cu失电子产生Cu2+,阳极发生反应:Cu-2e-=Cu2+,
又由信息可知,同时又发生反应2Cu2++4I-=2CuI↓+I2,生成I2,I2遇淀粉变蓝,有白色CuI沉淀生成.
I-和OH-移向阳极,而失电子能力Cu>I->OH-,故Cu失电子产生Cu2+,阳极发生反应:Cu-2e-=Cu2+,
又由信息可知,同时又发生反应2Cu2++4I-=2CuI↓+I2,生成I2,I2遇淀粉变蓝,有白色CuI沉淀生成.
解答:解:石墨为阴极,以Cu为阳极电解KI溶液,通电后,溶液中的H+、K+移向阴极,而H+的氧化性强于K+,所以H+得电子被还原,电极反应式为2H2O++2e-=H2↑+2OH-,破坏了水的电离平衡,使c(OH-)>c(H+),酚酞试液变红;
I-和OH-移向阳极,而失电子能力Cu>I->OH-,故Cu失电子产生Cu2+,阳极发生反应:Cu-2e-=Cu2+,
又由信息可知,同时又发生反应2Cu2++4I-=2CuI↓+I2,生成I2,I2遇淀粉变蓝,有白色CuI沉淀生成
A.通电后,溶液中的H+、K+移向阴极,而H+的氧化性强于K+,所以H+得电子被还原,电极反应式为2H2O++2e-=H2↑+2OH-,破坏了水的电离平衡,使c(OH-)>c(H+),酚酞试液变红,故A错误;
B.由上述分析可知,阴极区溶液呈红色,阳极Cu失电子产生Cu2+,生成Cu2+与I-能反应产生I2、CuI,Cu2+不能向阴极移动,故B错误;
C.阳极发生反应:Cu-2e-=Cu2+,又由信息可知,同时又发生反应2Cu2++4I-=2CuI↓+I2,故阳极反应为2Cu+4I--4e-=2CuI↓+I2,CuI是白色沉淀,故C正确;
D.阳极发生反应:Cu-2e-=Cu2+,又由信息可知,同时又发生反应2Cu2++4I-=2CuI↓+I2,故阳极反应为2Cu+4I--4e-=2CuI↓+I2,I2遇淀粉变蓝,故D错误;
故选C.
I-和OH-移向阳极,而失电子能力Cu>I->OH-,故Cu失电子产生Cu2+,阳极发生反应:Cu-2e-=Cu2+,
又由信息可知,同时又发生反应2Cu2++4I-=2CuI↓+I2,生成I2,I2遇淀粉变蓝,有白色CuI沉淀生成
A.通电后,溶液中的H+、K+移向阴极,而H+的氧化性强于K+,所以H+得电子被还原,电极反应式为2H2O++2e-=H2↑+2OH-,破坏了水的电离平衡,使c(OH-)>c(H+),酚酞试液变红,故A错误;
B.由上述分析可知,阴极区溶液呈红色,阳极Cu失电子产生Cu2+,生成Cu2+与I-能反应产生I2、CuI,Cu2+不能向阴极移动,故B错误;
C.阳极发生反应:Cu-2e-=Cu2+,又由信息可知,同时又发生反应2Cu2++4I-=2CuI↓+I2,故阳极反应为2Cu+4I--4e-=2CuI↓+I2,CuI是白色沉淀,故C正确;
D.阳极发生反应:Cu-2e-=Cu2+,又由信息可知,同时又发生反应2Cu2++4I-=2CuI↓+I2,故阳极反应为2Cu+4I--4e-=2CuI↓+I2,I2遇淀粉变蓝,故D错误;
故选C.
点评:本题考查电解原理,注意掌握离子放电顺序,明确电极反应式是关键,难度中等.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
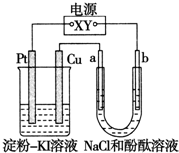 (2011?浙江五校高三联考)CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-═2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在淀粉-KI溶液中阳极周围变蓝色,则下列说法正确的是( )
(2011?浙江五校高三联考)CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-═2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在淀粉-KI溶液中阳极周围变蓝色,则下列说法正确的是( )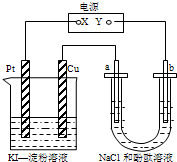 CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI-淀粉溶液中阳极周围变蓝色,则下列说法正确的是( )
CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI-淀粉溶液中阳极周围变蓝色,则下列说法正确的是( )