题目内容
【题目】如图,A是淡黄色固体,B的焰色反应为黄色,C是目前使用最多的半导体,
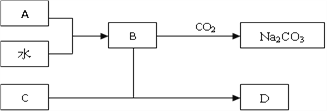
(1)A的化学式为______,为何盛装B溶液的试剂瓶不能用磨口玻璃塞,请用化学方程式解释____________________________。
(2)D的水溶液呈___性,将过量CO2通入D溶液中,现象为__________。
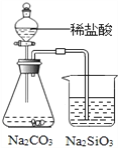
(3)为证明酸性:碳酸 > 硅酸,有同学设计如右实验装置:
请指出该装置中不合理之处____________
【答案】 Na2O2 SiO2+2NaOH=Na2SiO3+H2O 碱 有白色沉淀生成。 盐酸有挥发性,通入Ns2SiO3溶液中的既有CO2也有HCl气体,不能说明碳酸的酸性强于硅酸(答案合理即可给分)
【解析】试题分析:A是淡黄色固体,B的焰色反应为黄色,所以A是过氧化钠,B是氢氧化钠;C是目前使用最多的半导体,C为硅。硅与氢氧化钠反应生成硅酸钠和氢气。
解析:根据以上分析,(1)过氧化钠的化学式为Na2O2,二氧化硅与氢氧化钠反应生成硅酸钠,所以盛装氢氧化钠溶液的试剂瓶不能用磨口玻璃塞,化学方程式为SiO2+2NaOH=Na2SiO3+H2O。
(2)硅酸钠是强碱弱酸盐,水溶液呈碱性,将过量CO2通入硅酸钠溶液中生成白色硅酸沉淀。
(3)盐酸具有挥发性,盐酸、二氧化碳都能使硅酸钠溶液生成硅酸沉淀,通入Ns2SiO3溶液中的既有CO2也有HCl气体,不能说明碳酸的酸性强于硅酸。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目