��Ŀ����
����Ŀ���о����������̼��������ȴ�����Ⱦ��Ĵ���������Ҫ���塣
I.��֪����N2(g)+O2(g)=2NO(g) ��H=+180.5 kJ��mol-1
��CO��ȼ���ȡ�H=-283 kJ��mol-1��
(1)�����������ڰ�װ�Ĵ�ת��������ʹβ������Ҫ��Ⱦ��(NO��CO)ת��Ϊ���Ĵ���ѭ�����ʣ��÷�Ӧ���Ȼ�ѧ����ʽΪ________________________________��
(2)һ���¶��£��ں����ܱ������г���1 mol NO��2 mol CO���и÷�Ӧ�����в����жϷ�Ӧ�ﵽ��ѧƽ��״̬����___________(��������)
�ٵ�λʱ��������a mol CO��ͬʱ����2a mol NO
�ڻ�������ƽ����Է����������ٸı�
�ۻ��������NO��CO�����ʵ���֮�ȱ��ֲ���
�ܻ��������ܶȲ��ٸı�
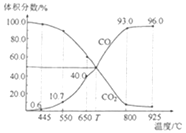
II.��������������������Լ�����������ӦΪ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)����ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⡣��Ӧ������n(O2)��ʱ��(t)�仯������±���
N2O5(g)+O2(g)����ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⡣��Ӧ������n(O2)��ʱ��(t)�仯������±���

(3)T1______T2(��>��<��=����ͬ)���÷�Ӧ��H________0��
(4)�������У�0��3s�ڵ�ƽ����Ӧ����v(NO2)=________��
(5)��������NO2ƽ��ת����Ϊ__________��T1ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ__________��
���𰸡�2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=-746.5 kJ/mol �٢� > < 0.24 mol/(L��s) 80.0% 20
N2(g)+2CO2(g) ��H=-746.5 kJ/mol �٢� > < 0.24 mol/(L��s) 80.0% 20
��������
I��(1)����֪�������Ȼ�ѧ����ʽ���ӣ��ɵ���Ӧ���Ȼ�ѧ����ʽ��
(2)���ݻ�ѧƽ��״̬��������𣬵���Ӧ�ﵽƽ��״̬ʱ�������淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯��
II��(3)������Ӧ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)���¶ȸߣ����ʿ죬�ﵽƽ������Ҫ��ʱ�����̣��ݴ˷����Ƚ��¶ȣ������¶���O2��ƽ�⺬�������жϣ�
N2O5(g)+O2(g)���¶ȸߣ����ʿ죬�ﵽƽ������Ҫ��ʱ�����̣��ݴ˷����Ƚ��¶ȣ������¶���O2��ƽ�⺬�������жϣ�
(4)���ڼ������У�0��3s�ڵ�ƽ����Ӧ����v(NO2)=2v(O2)������ͼ�����ݼ��������ķ�Ӧ���ʵõ���
(5)����O2��ƽ��Ũ�ȼ���������ʵ�ƽ��Ũ�ȣ�Ȼ����������ת���ʵ���ת��������ʼ���ıȼ���NO2��ת���ʣ�����ƽ�ⳣ�������������¶�ΪT1ʱ��ƽ�ⳣ����
I��(1)��֪����N2(g)+O2(g)=2NO(g) ��H=+180.5 kJ/mol
��CO��ȼ���ȡ�H=-283 kJ/mol���Ȼ�ѧ����ʽ��CO(g)+![]() O2(g)=CO2(g) ��H=-283.0 kJ/mol
O2(g)=CO2(g) ��H=-283.0 kJ/mol
���ݸ�˹���ɼ������2-�ٵõ��÷�Ӧ���Ȼ�ѧ����ʽ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=-746.5 kJ/mol��
N2(g)+2CO2(g) ��H=-746.5 kJ/mol��
(2)�ٵ�λʱ��������a mo1CO��ͬʱ����2a mol NO����Ӧ������У������淴Ӧ���ʲ��ȣ�˵��û�з�Ӧ�ﵽƽ��״̬���ٴ���
�ڷ�Ӧǰ�������������䣬�������ʵ���Ϊ����������������ƽ����Է����������ٸı䣬˵������ֵ�Ũ�Ȳ��ٱ仯���÷�Ӧ�ﵽƽ��״̬������ȷ��
��һ���¶��£��ں����ܱ������г���1 mol NO��2 mol CO���и÷�Ӧ����Ӧ��NO��CO����1��1��Ӧ���У����������NO��CO�����ʵ���֮�ȱ��ֲ��䣬˵����Ӧ�ﵽƽ��״̬������ȷ��
�ܷ�Ӧǰ������������������䣬���������ܶ�ʼ�ղ��ı䣬���ܸ��ݻ��������ܶ��ж�ƽ��״̬���ܴ���
�ʺ���ѡ���Ǣ٢ܣ�
II��(3)���淴Ӧ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)���ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⣬ͼ�����ݿ�֪���������дﵽƽ��ʱ��̣����ʿ죬˵����Ӧ���¶ȸߣ�����¶�T1>T2�����ݱ������ݿ�֪�������¶ȣ���Ӧ�ﵽƽ��ʱ O2�ĺ������¶ȵ�ʱ�ͣ�˵�������¶ȣ���ѧƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ����ø÷�Ӧ������ӦΪ���ȷ�Ӧ�����ԡ�H<0��
N2O5(g)+O2(g)���ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⣬ͼ�����ݿ�֪���������дﵽƽ��ʱ��̣����ʿ죬˵����Ӧ���¶ȸߣ�����¶�T1>T2�����ݱ������ݿ�֪�������¶ȣ���Ӧ�ﵽƽ��ʱ O2�ĺ������¶ȵ�ʱ�ͣ�˵�������¶ȣ���ѧƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ����ø÷�Ӧ������ӦΪ���ȷ�Ӧ�����ԡ�H<0��
(4)�������У�0��3s�ڵ�ƽ����Ӧ����v(NO2)=2v(O2)=2�� =0.24 mol/(L��s)��
=0.24 mol/(L��s)��
���ڼ�������������Ӧ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)����Ӧ�ﵽƽ��ʱn(O2)=0.8 mol����ͬʱ��Ӧn(N2O5)=n(O2)=0.8 mol����Ӧ����n(O3)=0.8 mol��n(NO2)=2��0.8 mol=1.6 mol������ƽ��ʱn(N2O5)=2.0 mol-1.6 mol=0.4 mol��n(O3)=1.0 mol-0.8 mol=0.2 mol��n(N2O5)=n(O2)=0.8 mol�����Լ�������NO2ƽ��ת����=
N2O5(g)+O2(g)����Ӧ�ﵽƽ��ʱn(O2)=0.8 mol����ͬʱ��Ӧn(N2O5)=n(O2)=0.8 mol����Ӧ����n(O3)=0.8 mol��n(NO2)=2��0.8 mol=1.6 mol������ƽ��ʱn(N2O5)=2.0 mol-1.6 mol=0.4 mol��n(O3)=1.0 mol-0.8 mol=0.2 mol��n(N2O5)=n(O2)=0.8 mol�����Լ�������NO2ƽ��ת����=![]() ��100%=80.0%����Ӧ�������ݻ���1L�����Ը������ʵ�ƽ��ʱ�����ʵ���Ϊ���ʵ�ƽ��Ũ�ȣ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=
��100%=80.0%����Ӧ�������ݻ���1L�����Ը������ʵ�ƽ��ʱ�����ʵ���Ϊ���ʵ�ƽ��Ũ�ȣ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() =20��
=20��