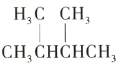题目内容
【题目】(1)物质的量浓度相同的下列物质的溶液①NH4Cl ②NH4HSO4③CH3COONH4,c(NH4+)由小到大的顺序是_______________(填序号)。
(2)同浓度的下列溶液:①CH3COONH4②NH4Cl ③Na2CO3④NaHCO3,其中pH由大到小的顺序 是_________________。
(3)物质的量浓度相同的 ①盐酸、②硫酸溶液、 ③醋酸(CH3COOH)溶液各100 mL分别与足量的Zn反应,在相同的条件下,产生H2的体积分别为V1、V2、V3,它们由大到小的顺序是____________。
(4)CH3COONa溶液呈_____性(填“酸”、“碱”或“中”),其原因是______(用离子方程式表示)。
(5)常温时,若10体积pH1=a的盐酸溶液与1体积pH2=b的氢氧化钠溶液混合后溶液呈中性,则混合前该强酸的pH1与强碱的pH2之间应满足的关系是_________________。
【答案】③①② ③④①② V2>V3= V1 碱 CH3COO-+H2O![]() CH3COOH+OH- a+b=15或pH1+pH2=15
CH3COOH+OH- a+b=15或pH1+pH2=15
【解析】
(1)NH4Cl 溶液中Cl-对 NH4+的水解无影响,NH4HSO4溶液中的HSO4-电离溶液显酸性,抑制了NH4+的水解,NH4+的浓度较大,CH3COONH4溶液中CH3COO-水解溶液显碱性,会促进NH4+的水解,使得NH4+的浓度较小,所以NH4+离子浓度由大到小的顺序是③①②;
(2)CH3COO-和NH4+水解程度相当,溶液略显中性,NH4Cl溶液中NH4+的水解使得溶液向酸性, Na2CO3和NaHCO3溶液由于CO32-和HCO3-的水解使得溶液显碱性,但是CO32-比HCO3-的水解程度要大,所以Na2CO3溶液的碱性比NaHCO3要强,故pH 由大到小的顺序 是③④①②;
(3)盐酸和醋酸是一元酸,物质的量浓度和体积相同时能够电离出来的H+的物质的量相同,与Zn反应放出的气体相等,硫酸是二元酸,物质的量浓度和体积相等时比盐酸、醋酸能电离出更多的H+,所以放出的气体更多,V1、V2、V3故由大到小的顺序是V2>V3= V1;
(4)CH3COONa溶液呈碱性,原因是CH3COO-水解使得溶液显碱性,离子方程式为:CH3COO-+H2O![]() CH3COOH+OH-;
CH3COOH+OH-;
(5)pH1=a的盐酸溶液中c(H+)=10-amol/L,pH2=b的氢氧化钠溶液中c(OH-)=10b-14mol/L,10体积pH1=a的盐酸溶液与1体积pH2=b的氢氧化钠溶液混合后溶液呈中性,则有10×10-a=1×10b-14,得a+b=15,或pH1+pH2=15。

【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用k表示).下表是25℃下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.96×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2SO3 | H2SO3 HSO3- | K1=1.54×10-2 K2= 1.02×10-7 |
回答下列问题:
(1)CH3COOH、HClO、H2CO3、HCO3-、H2SO3、HSO3-都可看作是酸,其中酸性最强的是_________,最弱的是________________。
(2)向Na2CO3溶液中通入足量的氯气,发生的离子方程式为______________________,向NaClO溶液中通入少量的二氧化硫,发生的离子方程式为____________________________________。
(3)求25℃时,1.2mol/L 的NaClO溶液pH=____________(己知:lg2=0.3),0.10mol/L的CH3COOH溶液中的c(H+)=______________mol/L。
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |