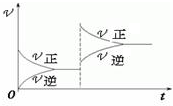
题目内容
对于可逆反应:2SO2(g)+O2(g)?2SO3(g)△H<0,降低温度产生的影响为( )
| A.v正增大,v逆减小 |
| B.v正减小,v逆增大 |
| C.v正和v逆同程度的减小 |
| D.v正和v逆不同等程度的减小 |
A、降低温度,正逆化学反应速率都减小,即v正减小,v逆 减小,故A错误;
B、降低温度,正逆化学反应速率都减小,即v正减小,v逆 减小,故B错误;
C、降低温度,化学平衡向着放热方向进行,即向着正方向进行,正反应速率大于逆反应速率,即正反应速率增加的程度大,故C错误;
D、降低温度,化学平衡向着放热方向进行,即向着正方向进行,但是增加程度不一样,正逆反应速率不相等,正反应速率大于逆反应速率,正反应速率减小的少,故D正确;
故选:D.
B、降低温度,正逆化学反应速率都减小,即v正减小,v逆 减小,故B错误;
C、降低温度,化学平衡向着放热方向进行,即向着正方向进行,正反应速率大于逆反应速率,即正反应速率增加的程度大,故C错误;
D、降低温度,化学平衡向着放热方向进行,即向着正方向进行,但是增加程度不一样,正逆反应速率不相等,正反应速率大于逆反应速率,正反应速率减小的少,故D正确;
故选:D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目