题目内容
| |||||||||||||||||||||||||||
答案:2.AC;
解析:
解析:
(1) |
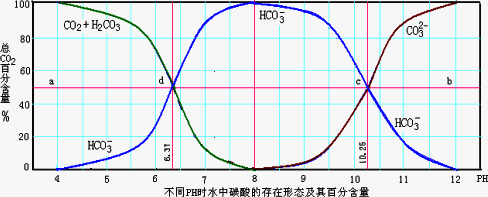
碱 PH约等于8时,c(HCO3-)最大,c(CO32-)最少,说明HCO3-极少电离. |
(3) |
c(CO32-)≥1.01×10-5 |
(4) |
能 因为PH |

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目

 B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性
B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性