题目内容
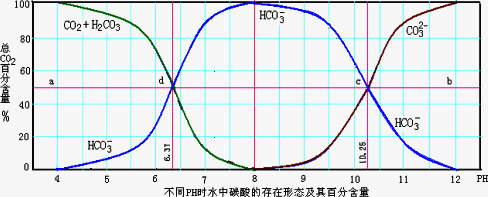
工业上通常把溶液中存在的CO32-和HCO3-的总浓度称为总碱度。水中碱度的控制成为碳酸钠软化水处理 法的关键。碳酸在水中一般以3种形态存在,即H2CO3 (CO2)、CO32-和HCO3-。当溶液的pH发生变化时, 其中任一种形态的物质的量占三种形态总物质的量的分δ也可能发生变化,下图是碳酸溶液中碳酸的各种形态的δ随pH的变化曲线。

(1)从图中推断NaHCO3溶液呈___(填“酸”、“碱”或“中”)性,其原因是____ (用离子方程式表示)。
(2)正常情况下,人体血液的pH维持在7.35~7.45之间,则溶于血液中的二氧化碳的主要存在形式是 ____(填写微粒化学式)。
(3)根据上图,下列叙述中正确的是____。
A.HCO3-既能与强酸反应又能与强碱反应
B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性
C.pH小于7的雨水称为酸雨
D.在pH为6.37时,溶液中的c(H2CO3)=c(HCO3-)
(4)工业用循环冷却水中常含有Ca2+等杂质离子,在循环过程中易结垢,可通过控制溶液的总碱度使Ca2+等离子形成沉渣除去。已知某温度下Ksp(CaCO3)=3. 03×10-9,当水中的c(Ca2+)≤3×10-4 mol.L-1时,不会出现结垢现象,则该水中的c(CO32-)应至少为____mol.L-1。
(2)正常情况下,人体血液的pH维持在7.35~7.45之间,则溶于血液中的二氧化碳的主要存在形式是 ____(填写微粒化学式)。
(3)根据上图,下列叙述中正确的是____。
A.HCO3-既能与强酸反应又能与强碱反应
B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性
C.pH小于7的雨水称为酸雨
D.在pH为6.37时,溶液中的c(H2CO3)=c(HCO3-)
(4)工业用循环冷却水中常含有Ca2+等杂质离子,在循环过程中易结垢,可通过控制溶液的总碱度使Ca2+等离子形成沉渣除去。已知某温度下Ksp(CaCO3)=3. 03×10-9,当水中的c(Ca2+)≤3×10-4 mol.L-1时,不会出现结垢现象,则该水中的c(CO32-)应至少为____mol.L-1。
(1)碱; HCO3-+H2O H2CO3+OH-
H2CO3+OH-
(2)HCO3-
(3)AD
(4)1. 01×10-5
 H2CO3+OH-
H2CO3+OH- (2)HCO3-
(3)AD
(4)1. 01×10-5

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
| |||||||||||||||||||||||||||

 B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性
B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性