题目内容
8.钼酸钠晶体(Na2MoO4•2H2O)可用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂.如图所示是利用钼精矿(主要成分为MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图.
请回答下列问题:
(1)Na2MoO4中Mo的化合价为+6
(2)“焙烧”时,有MoO3生成,反应的化学方程式为2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2,氧化产物是MoO3、SO2
(3)“碱浸”生成CO2和另外一种物质,CO2的电子式为
 ,另外一种生成物的化学式为Na2MoO4
,另外一种生成物的化学式为Na2MoO4(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣的成分为PbS(填化学式)
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol•L-1,c(SO42-)=0.04mol•L-1.“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体.假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO42-的质量分数为97.3%.(保留小数点后一位数字)〔已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8〕
(6)在碱性条件下,将钼精矿加入NaClO溶液中,也可以制备钼酸钠.该反应的离子方程式为MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O.
分析 灼烧钼精矿,MoS2燃烧,反应方程式为2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,然后向溶液中加入沉淀剂除去重金属离子,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4.2H2O,
(1)根据在化合物中正负化合价代数和为零计算;
(2)焙烧过程中钼精矿发生的主要反应的化学方程式为:2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2,元素化合价升高的失去电子发生氧化反应得到氧化产物;
(3)二氧化碳使共价化合物,碳原子分别和氧原子形成两个共价键,据此书写电子式,碱性条件下,MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠;
(4)除重金属离子就是出去溶液中的Pb2+,生成硫化铅;
(5)根据钼酸钡和硫酸钡的溶度积计算出溶液中硫酸根离子的浓度,在再计算出SO42-的去除率;
(6)用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,同时有SO42-生成,据此可写出离子反应方程式.
解答 解:(1)计算结晶水合物钼钼酸钠中元素的化合价只计算Na2MoO4中钼元素的化合价即可,钠元素显+1,氧元素显-2,设钼元素的化合价是x,根据在化合物中正负化合价代数和为零,可知钼酸钠(Na2MoO4•2H2O)中钼元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6,
故答案为:+6;
(2)焙烧过程中钼精矿发生的主要反应的化学方程式为:2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2,元素化合价升高的失去电子发生氧化反应得到氧化产物,反应中Mo元素化合价+2价变化为+6价,硫元素化合价-1价变化为+4价,该反应中氧化产物是MoO3、SO2,
故答案为:2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2;MoO3、SO2;
(3)二氧化碳为共价化合物,分子中存在两个碳氧双键,二氧化碳正确的电子式为: ,碱性条件下,MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠,化学方程式为:MoO3+Na2CO3=Na2MoO4+CO2↑,另一种产物为Na2MoO4,
,碱性条件下,MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠,化学方程式为:MoO3+Na2CO3=Na2MoO4+CO2↑,另一种产物为Na2MoO4,
故答案为: ;Na2MoO4;
;Na2MoO4;
(4)由钼精矿的杂质为PbS可知,除重金属离子就是出去溶液中的Pb2+,因此废渣为PbS,
故答案为:PbS;
(5)BaMoO4开始沉淀时,C(Ba2+)=$\frac{Ksp(BaMo{O}_{4})}{c(Mo{O}_{4})}$=$\frac{4.0×1{0}^{-8}}{0.40}$mol•L-1=1.0×10-7mol•L-1,
故溶液中C(SO42-)=$\frac{Ksp(BaS{O}_{4})}{c(B{a}^{2+})}$=$\frac{1.1×1{0}^{-10}}{1.1×1{0}^{-7}}$mol•L-1=1.1×10-3mol•L-1,
故去除的SO42-的质量分数为1-$\frac{1.1×1{0}^{-3}}{0.04}$×100%=1-2.75%≈97.3%,
故答案为:97.3;
(6)ClO-作氧化剂,将MoS2氧化成MoO42-和SO42-,用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为:MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,
故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O.
点评 本题考查物质的制备以及物质分离和提纯的方法和基本操作综合应用,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,题目主要涉及分离提纯的方法、物质性质的分析应用等知识,题目难度中等.

| A. |  过滤时,应将漏斗颈尖嘴处紧贴烧杯内壁 | |
| B. |  蒸发时,当溶液完全蒸干时应立即停止加热 | |
| C. |  蒸馏时,应将开始馏出的部分液体弃去 | |
| D. |  分液时,当下层液体刚好放完时应立即关闭活塞,以免上层液体流出 |
| A. | 保持容器容积不变,向其中加入1 mol H2(g),再将平衡时反应速率一定加快 | |
| B. | 保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快 | |
| C. | 保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),再次平衡时反应速率一定加快 | |
| D. | 保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),再次平衡时反应速率一定加快 |
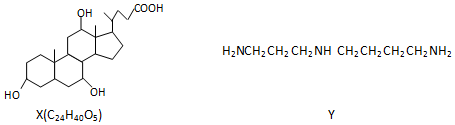
下列叙述错误的是( )
| A. | 1molX在浓硫酸作用下发生消去反应,最多生成3molH2O | |
| B. | 1molY发生类似酯化的反应,最多消耗2molX | |
| C. | X与足量HBr反应,所得有机物的分子式为C24H37O2Br3 | |
| D. | Y与癸烷的分子链均呈锯齿形,但Y的极性较强 |
| A. | 卤素单质的熔点按F2、Cl2、Br2、I2的顺序依次减小 | |
| B. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 | |
| C. | 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 | |
| D. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 |
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
①R的氧化物对应的水化物可能具有两性
②X单质可在氧气中燃烧生成XO3
③离子半径大小:r(M3+)<r(T2-)
④L2+和X2-的核外电子数相等.
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ①②③ |