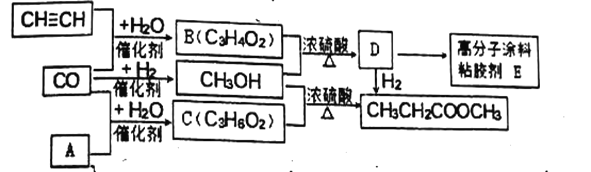
题目内容
【题目】某同学制作的燃料电池示意图如下,先闭合K1接通电源一段时间后,再断开K1、闭合K2 时,电流表指针偏转。下列分析正确的是

A.闭合K1时,Na2SO4开始电离
B.闭合K1时,石墨a 附近溶液逐渐变红
C.断开K1、闭合K2时,石墨a 附近溶液酸性逐渐减弱
D.断开K1、闭合K2时,石墨b极上发生反应:H22e-=2H+
【答案】C
【解析】
闭合K1时,装置为电解池,电解质溶液为Na2SO4溶液,则该装置电解水,石墨a(阳极)的电极反应为:4OH--4e-=O2↑+2H2O,石墨b(阴极)的电极反应为:4H++4e-=2H2↑;断开K1、闭合K2时,电流表发生偏转说明该装置内有电流产生,则该装置转变为了原电池,反应是电解池产生的O2和H2(题中也说明了是燃料电池),原本O2在石墨a电极上产生,H2在石墨b电极上产生,故石墨a作正极,电极反应为O2+2H2O+4e-=4OH-,石墨b作负极,电极反应为2H2-4e-=4H+。
A、Na2SO4遇水形成溶液就开始电离,不需要等到通电才发生电离,A错误;
B、闭合K1时,装置为电解池,石墨a为阳极,其电极反应为4OH--4e-=O2↑+2H2O,由于该电极消耗OH-,故该电极附近溶液不会变红,B错误;
C、断开K1、闭合K2时,该装置转变为了原电池,石墨a作正极,电极反应为O2+2H2O+4e-=4OH-,由此可见石墨a 附近溶液酸性逐渐减弱,C正确;
D、断开K1、闭合K2时,石墨b极作负极,电极反应为2H2-4e-=4H+,D错误;
故选C。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下:
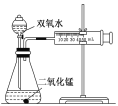
分析表中数据回答下列问题:
MnO2 时间 H2O2 | 0.1g | 0.3g | 0.8g |
10mL1.5% | 223s | 67s | 56s |
10mL3.0% | 308s | 109s | 98s |
10mL4.5% | 395s | 149s | 116s |
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而________。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是__________________________________。
(4)为加快过氧化氢的分解速率,除了使用MnO2作催化剂和改变过氧化氢的质量分数之外,还可以采取的加快反应速率的措施有_____。(回答任意两个合理的措施)