题目内容
【题目】[化学——选修3:物质结构与性质](15分)
已知:A、B、C、D四种元素,原子序数依次增大。A是短周期元素中金属性最强的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关问题:
(1)写出D元素价电子的电子排布式___________。
(2)D可形成化合物[D(H2O)6](NO3)3。
①[D(H2O)6](NO3)3中阴离子的立体构型是 。NO3中心原子的轨道杂化类型为 。
②在[D(H2O)6]3+中D3+与H2O之间形成的化学键称为____ __,1 mol [D(H2O)6] 3+中含有的σ键有 mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中 (填化学式)为非极性分子。另一种物质的电子式为 。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个A+最近的C有______个,这些C围成的图形是________;若晶体密度为ρ g·cm3,阿伏加德罗常数的值用NA表示,则A+的离子半径为_______cm(用含NA与ρ的式子表达)。
【答案】(1)3d54s1(2分)
(2)①平面三角形(1分) sp2杂化(1分) ②配位键(1分) 18(2分)
(3)PCl5(1分) ![]() (1分)
(1分)
(4)6(2分) 正八面体(2分)  (2分)
(2分)
【解析】A是短周期中原子半径最大的元素,则A为钠元素;B元素3p能级半充满且原子序数比A大,则B为磷元素;D是第四周期未成对电子最多的元素,则D的电子排布为[Ar]3d54s1,该元素为铬;C只能位于第三周期,该周期电负性最大的元素是氯元素。
(1)D为铬元素,其价电子排布为3d54s1。(2)①NO3中心原子氮原子的价电子对数为![]() =3,所以N原子为sp2杂化轨道,对应的立体构型是平面三角形。②在[Cr(H2O)6]3+中Cr3+有空的原子轨道,而H2O分子的氧原子有孤对电子,H2O中的孤对电子填充Cr3+的空轨道而形成配位键,[D(H2O)6]3+中6个配位键都是σ键,每个水分子内氧原子与氢原子形成2个σ键,因此1 mol [D(H2O)6] 3+中含有18 mol的σ键。(3)B、C形成的两种常见化合物为PCl5和PCl3,其中PCl5分子中磷原子的价电子全部参与成键,没有孤对电子,磷原子与氯原子形成5个共价键,空间构型为三角双锥形,电荷分布对称,正负电荷重心重合,所以是非极性分子。PCl3中磷原子有3个电子与氯原子共用,形成3个共价键,有一对孤对电子,是极性分子,其电子式为:
=3,所以N原子为sp2杂化轨道,对应的立体构型是平面三角形。②在[Cr(H2O)6]3+中Cr3+有空的原子轨道,而H2O分子的氧原子有孤对电子,H2O中的孤对电子填充Cr3+的空轨道而形成配位键,[D(H2O)6]3+中6个配位键都是σ键,每个水分子内氧原子与氢原子形成2个σ键,因此1 mol [D(H2O)6] 3+中含有18 mol的σ键。(3)B、C形成的两种常见化合物为PCl5和PCl3,其中PCl5分子中磷原子的价电子全部参与成键,没有孤对电子,磷原子与氯原子形成5个共价键,空间构型为三角双锥形,电荷分布对称,正负电荷重心重合,所以是非极性分子。PCl3中磷原子有3个电子与氯原子共用,形成3个共价键,有一对孤对电子,是极性分子,其电子式为:![]() 。(4)A、C两元素形成的化合物为NaCl,从晶胞结构看,黑球半径小代表Na+,白球半径大代表Cl,现选定立方体中心的Na+作为研究对象,则距离该Na+最近的Cl分别位于6个面的面心,这6个Cl围成一个正八面体。晶胞中的1个Na+位于体心,12个Na+分别位于12条棱的中点,根据均摊法可求得该晶胞拥有的Na+数为:1+12×
。(4)A、C两元素形成的化合物为NaCl,从晶胞结构看,黑球半径小代表Na+,白球半径大代表Cl,现选定立方体中心的Na+作为研究对象,则距离该Na+最近的Cl分别位于6个面的面心,这6个Cl围成一个正八面体。晶胞中的1个Na+位于体心,12个Na+分别位于12条棱的中点,根据均摊法可求得该晶胞拥有的Na+数为:1+12×![]() =4;晶胞中6个面的面心各有1个Cl,八个顶点各有一个Cl,同理可求得该晶胞拥有的Cl数为:6×
=4;晶胞中6个面的面心各有1个Cl,八个顶点各有一个Cl,同理可求得该晶胞拥有的Cl数为:6×![]() +8×
+8×![]() =4;设晶胞的边长为a,则由密度公式可得ρ ·a3 = 4×
=4;设晶胞的边长为a,则由密度公式可得ρ ·a3 = 4×![]() ,变形得a=
,变形得a= ,从晶胞截面图得 a=2r++2r(r+、r分别表示Na+和Cl的半径),4r=
,从晶胞截面图得 a=2r++2r(r+、r分别表示Na+和Cl的半径),4r=![]() (4r为截面对角线长度),则r+=
(4r为截面对角线长度),则r+=![]() (a2r)=
(a2r)=  ,此即为所求的Na+半径。
,此即为所求的Na+半径。

 阅读快车系列答案
阅读快车系列答案【题目】过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:

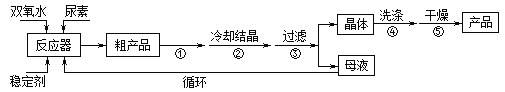
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。



