题目内容
A、B、C、D、E五种短周期元素,已知:
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数
;
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式:
(2)C2A4?H2O与NH3?H2O相似,水溶液也呈弱碱性,用化学用语表示其水溶液呈弱碱性的原因: ;
(3)B、D、E三元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化.当a mol Y转化成a mol X时:(溶液中进行)
①若加入a mol 纯净物Z就可实现转化,则加入Z为: (填一种Z物质名称)
②若加入0.5a mol 纯净物Z就可实现转化,则加入Z为: (填一种Z物质化学式)
(4)C2A4可用作高能燃料电池的燃料,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极方程式: ;
用该电池电解含0.25mol CuSO4和0.5mol NaCl混合溶液,当电池消耗10.4g C2A4时,则两电极生成的气体共 mol.
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数
| 1 | 3 |
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式:
(2)C2A4?H2O与NH3?H2O相似,水溶液也呈弱碱性,用化学用语表示其水溶液呈弱碱性的原因:
(3)B、D、E三元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化.当a mol Y转化成a mol X时:(溶液中进行)
①若加入a mol 纯净物Z就可实现转化,则加入Z为:
②若加入0.5a mol 纯净物Z就可实现转化,则加入Z为:
(4)C2A4可用作高能燃料电池的燃料,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极方程式:
用该电池电解含0.25mol CuSO4和0.5mol NaCl混合溶液,当电池消耗10.4g C2A4时,则两电极生成的气体共
分析:A、B、C、D、E五种短周期元素,已知:原子半径递增顺序为:A、D、C、B、E.短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小,则A为H元素、E为Na元素;B、C、D三种元素电子层相同,三者原子序数之和为21,平均原子序数为7,故都处于第二周期,D原子次外层电子数为最外层电子数
,则最外层电子数为6,故D为O元素,则B、C原子序数之和为21-8=13,原子半径B>C,则B为碳元素、C为N元素,据此解答.
| 1 |
| 3 |
解答:解:A、B、C、D、E五种短周期元素,已知:原子半径递增顺序为:A、D、C、B、E.短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小,则A为H元素、E为Na元素;B、C、D三种元素电子层相同,三者原子序数之和为21,平均原子序数为7,故都处于第二周期,D原子次外层电子数为最外层电子数
,则最外层电子数为6,故D为O元素,则B、C原子序数之和为21-8=13,原子半径B>C,则B为碳元素、C为N元素,
(1)Na单质在氧气中燃烧生成Na2O2,其电子式为: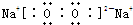 ,
,
故答案为: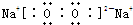 ;
;
(2)N2H4?H2O与NH3?H2O相似,在溶液中发生电离N2H4?H2O?N2H5++OH-,其水溶液呈弱碱性,
故答案为:N2H4?H2O?N2H5++OH-;
(3)C、O、Na三元素可组成常见化合物X,H、C、O、Na可组成常见化合物Y,X、Y均是生活中常见的化学试剂,则X为Na2CO3,Y为NaHCO3,它们在一定条件下可互相转化.当a molNaHCO3转化成a mol Na2CO3时(溶液中进行):
①若加入a mol 纯净物Z就可实现转化,则Z溶于是呈碱性,根据钠离子守恒可知,且1molZ中含有1molNa+,则加入Z为NaOH等,
故答案为:氢氧化钠;
②若加入0.5a mol 纯净物Z就可实现转化,则Z溶于是呈碱性,根据钠离子守恒可知,且1molZ中含有2molNa+,则加入Z为Na2O等,
故答案为:Na2O;
(4)N2H4可用作高能燃料电池的燃料,惰性材料作电极,KOH作电解质溶液构成原电池,N2H4失去电子发生氧化反应生成氮气与水,故负极的电极方程式为:N2H4-4e-+4OH-=N2+4H2O;
用该电池电解含0.25mol CuSO4和0.5mol NaCl混合溶液,电池消耗10.4g N2H4,其物质的量=
=0.325mol,转移电子为0.325mol×4=1.3mol,阴极0.25molCu2+完全析出生成Cu需要电子0.25mol×2=0.5mol<1.3mol,故阴极还生成氢气,氢气的物质的量为
=0.4mol,阳极0.5molCl-完全放电生成氯气失去电子为0.5mol<1.3mol,故阳极生成氯气为0.25mol,还生成氧气为
=0.2mol,故两电极生成的气体共有0.4mol+0.25mol+0.2mol=0.85mol,
故答案为:N2H4-4e-+4OH-=N2+4H2O;0.85mol.
| 1 |
| 3 |
(1)Na单质在氧气中燃烧生成Na2O2,其电子式为:
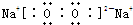 ,
,故答案为:
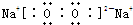 ;
;(2)N2H4?H2O与NH3?H2O相似,在溶液中发生电离N2H4?H2O?N2H5++OH-,其水溶液呈弱碱性,
故答案为:N2H4?H2O?N2H5++OH-;
(3)C、O、Na三元素可组成常见化合物X,H、C、O、Na可组成常见化合物Y,X、Y均是生活中常见的化学试剂,则X为Na2CO3,Y为NaHCO3,它们在一定条件下可互相转化.当a molNaHCO3转化成a mol Na2CO3时(溶液中进行):
①若加入a mol 纯净物Z就可实现转化,则Z溶于是呈碱性,根据钠离子守恒可知,且1molZ中含有1molNa+,则加入Z为NaOH等,
故答案为:氢氧化钠;
②若加入0.5a mol 纯净物Z就可实现转化,则Z溶于是呈碱性,根据钠离子守恒可知,且1molZ中含有2molNa+,则加入Z为Na2O等,
故答案为:Na2O;
(4)N2H4可用作高能燃料电池的燃料,惰性材料作电极,KOH作电解质溶液构成原电池,N2H4失去电子发生氧化反应生成氮气与水,故负极的电极方程式为:N2H4-4e-+4OH-=N2+4H2O;
用该电池电解含0.25mol CuSO4和0.5mol NaCl混合溶液,电池消耗10.4g N2H4,其物质的量=
| 10.4g |
| 32g/mol |
| 1.3mol-0.5mol |
| 2 |
| 1.3mol-0.5mol |
| 4 |
故答案为:N2H4-4e-+4OH-=N2+4H2O;0.85mol.
点评:本题以元素推断为载体,考查电子式、信息迁移、无机物推断、原电池原理及电解计算等,难度中等,(4)为易错点、难点,可以利用总反应式减正极反应式书写负极电极反应式,注意根据离子放电顺序结合电子转移守恒进行计算.

练习册系列答案
相关题目






 元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )