题目内容
【题目】向100 mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
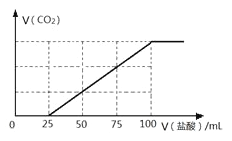
回答下列问题:
(1)原NaOH溶液的物质的量浓度为______ mol/L;
(2)题中通入CO2后所得溶液的溶质成分为______将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为_______ g。
【答案】2.0Na2CO3和NaHCO313.7 g
【解析】【试题分析】
向100 mLNaOH溶液中通入一定量CO2,充分反应后,所得溶液溶质可能为NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3四种情况,再向所得溶液中逐滴加入2.0 mol/L的盐酸,可能发生的反应为:①NaOH+HCl=NaCl +H2O、②Na2CO3+HCl=NaCl+NaHCO3、③NaHCO3+HCl=NaCl+CO2↑+H2O,结合着可能发生的反应,再根据产生CO2的体积与所加盐酸体积之间关系图,可得通入CO2之后溶质为Na2CO3和NaHCO3,滴加稀盐酸100ml之后溶质为NaCl。
(1)根据题意,NaOH最终转化为NaCl,由原子守恒可得:n(NaOH)= n(NaCl) =n(HCl),又因为100mLNaOH溶液对应100mL盐酸溶液, 所以c(NaOH)= c(HCl)=2.0 mol/L。
(2)由图像可得:滴入25mL稀盐酸后开始发生反应③产生CO2,NaHCO3共消耗了75mL稀盐酸,所以NaOH溶液中通入一定量CO2,充分反应后,所得溶液溶质为Na2CO3和NaHCO3。由图像可得:与Na2CO3反应的盐酸为0.025L×2.0 mol/L=0.05mol,所以Na2CO3为0.05mol,转化为NaHCO3为0.05mol,所以通CO2后生成的NaHCO3消耗的盐酸为0.05L×2.0 mol/L=0.1mol,所以混合物质量为:106g/mol×0.05mol+84g/mol×0.1mol =13.7g。

 天天向上口算本系列答案
天天向上口算本系列答案