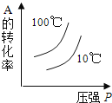
��Ŀ����
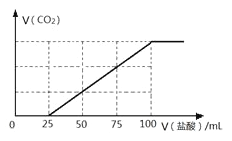
����Ŀ���ڽӴ���������������У�SO2ת����SO3ת���ʵĴ�Сֱ�Ӿ�������Ч�ʡ�ij�о�С������ͼװ��ģ�����������вⶨSO2ת����SO3��ת���ʡ���֪SO3���۵���16.8�����е���44.8����װ���������漰��Ӧ�Ļ�ѧ����ʽΪ�� ��
��1�����е��Լ��� ��������������Ϊ ��װ����������Ӧ�Ļ�ѧ����ʽ�� ��
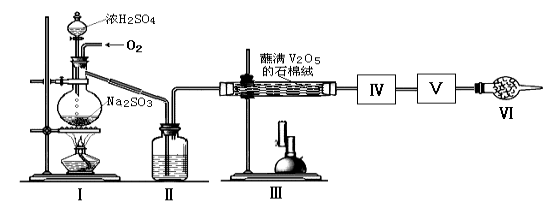
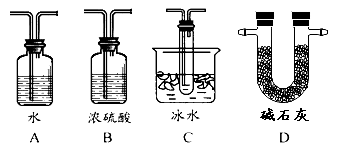
��2������ʵ����Ҫ��Ӧ���������������Ӻ��ʵ�װ�á������ͼA��Dװ����ѡ�����ʺ�װ�ò��������������Ŀո��У������������ӵ�װ�÷ֱ��� �� ��
��3��Ϊ�����SO2��ת���ʣ�ʵ��ʱ�ڣ����μ�Ũ��������ȴ����IJ����У�Ӧ��ȡ�IJ������Ⱥ�˳��_____________(����)��
��4��ʵ�������������ռ�SO3���Թܳ���¶���ڿ����У��ܹ������ܿ��д����İ����������������ԭ���� ��
��5����18.9gNa2SO3��ĩ��������Ũ��������д�ʵ�飬����Ӧ����ʱ������ͨ��O2һ��ʱ�����װ����������7.2g����ʵ����SO2��ת����Ϊ ��
���𰸡�Na2SO3+H2SO4=Na2SO4+SO2��+H2O
��1��Ũ���� ����� 2SO2+O2![]() 2SO3
2SO3
��2��C D ��3����
��4��SO3�ӷ�����������ˮ ��5��25%
��������
�������:��װ��Ϊʵ�����Ʊ����������װ�ã��������ƺ�Ũ������ȷ�Ӧ���ɶ�������Na2SO3+H2SO4=Na2SO4+SO2��+H2O����1�����е��Լ���Ũ���ᣬ���ն��������к��е�ˮ������������������Ϊ���θ���ܣ�װ����������ӦΪ�����������Ĵ�����������������2SO2+O2![]() 2SO3 ; ��2��SO3���۵���16.8�����е���44.8��,�ⶨSO2ת����SO3��ת���ʡ�A�ⶨ���ʣ��Ķ���������������ü�ʯ�������գ��漰����������ĸ������⣬����֮ǰ����SO3���۵���16.8���Ƚϵͣ��ñ�ˮ��ȴ������壬���������Ϊ���壬���ɴﵽĿ�ģ����ѡ���װ��Ϊ��C ��D�� ��3���÷�ӦΪһ�����ȵĿ��淴Ӧ�������Ĵ�Ч����Ҫһ�����¶ȣ���ˣ��ȸ�����Ԥ�ȣ�Ȼ����ͨ������������壬��ѡ����������4��SO3���������ˮ������Ӧ���������ᣬ�����������ȣ����������İ�������5��װ����������7.2g��Ϊʣ��Ķ�������������������ʵ���Ϊ9/80mol; ��Na2SO3+H2SO4=Na2SO4+SO2��+H2O�����Ķ����������������Ϊ18.9/126 =0.15 mol; ��Ӧ����n(SO2)= 18.9/126- 9/80=0.0375 mol ���Զ��������ת����Ϊ0.0375/0.15��100%=25%;
2SO3 ; ��2��SO3���۵���16.8�����е���44.8��,�ⶨSO2ת����SO3��ת���ʡ�A�ⶨ���ʣ��Ķ���������������ü�ʯ�������գ��漰����������ĸ������⣬����֮ǰ����SO3���۵���16.8���Ƚϵͣ��ñ�ˮ��ȴ������壬���������Ϊ���壬���ɴﵽĿ�ģ����ѡ���װ��Ϊ��C ��D�� ��3���÷�ӦΪһ�����ȵĿ��淴Ӧ�������Ĵ�Ч����Ҫһ�����¶ȣ���ˣ��ȸ�����Ԥ�ȣ�Ȼ����ͨ������������壬��ѡ����������4��SO3���������ˮ������Ӧ���������ᣬ�����������ȣ����������İ�������5��װ����������7.2g��Ϊʣ��Ķ�������������������ʵ���Ϊ9/80mol; ��Na2SO3+H2SO4=Na2SO4+SO2��+H2O�����Ķ����������������Ϊ18.9/126 =0.15 mol; ��Ӧ����n(SO2)= 18.9/126- 9/80=0.0375 mol ���Զ��������ת����Ϊ0.0375/0.15��100%=25%;
����:������Ʊ� �����ӡ��������衢ת���ʵļ��㡣