题目内容
5.以食盐为原料进行生产并综合利用的某些过程如图1所示.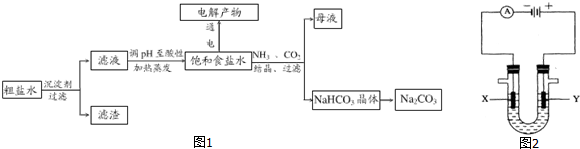
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填序号)cab或者cba或者bca.
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是OH-、CO32-.
(3)图2表示电解饱和NaCl溶液的装置,X、Y是石墨棒.实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是2H++2e-=H2↑,在X极附近观察到的现象是有无色气泡产生,溶液变红;Y电极上的电极反应式是2Cl--2e-=Cl2↑,检验该电极反应产物的方法是将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生.电解NaCl溶液的离子方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是NH3.
(5)常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是1×1010.
分析 (1)总体思路是先沉淀再过滤,沉淀时要先加BaCl2溶液,再加Na2CO3溶液,因为碳酸钠能把过量的氯化钡沉淀出来,氢氧化钠可放在它们前面,也可放在它们后面或中间,都完全沉淀完后再过滤;
(2)稀盐酸能和氢氧化钠、碳酸钠反应,蒸发时可以得到氯化钠的饱和溶液;
(3)根据电解氯化钠溶液的原理方程式以及氯气和氢氧化钠之间的反应结合题干来解答,检验氯气通常用用湿润的KI淀粉试纸;
(4)根据铵盐和碱反应能生成氨气分析,氯化铵能和氢氧化钙反应生成氯化钙、水和氨气;
(5)氢氧化钠中氢氧根离子是完全是水电离出的,碳酸钠溶液中氢氧根离子是水完全电离生成的,结合离子积计算判断.
解答 解:(1)加入氢氧化钠溶液时,能和氯化镁反应生成氢氧化镁沉淀和氯化钠,从而除去氯化镁;加入氯化钡时,能和硫酸钠反应生成硫酸钡沉淀和氯化钠,从而除去硫酸钠;加入碳酸钠溶液时,能和氯化钙、过量的氯化钡反应生成碳酸钙沉淀、碳酸钡沉淀和氯化钠,从而除去氯化钙和过量的氯化钡;过滤,向滤液中加入适量的稀盐酸时,可以把过量的氢氧化钠和碳酸钠除去.以此类推,如果依次加入氯化钡溶液、氢氧化钠溶液、碳酸钠溶液或依次加入氯化钡溶液、碳酸钠溶液、氢氧化钠溶液,可以达到同样的目的,
故答案为:cab或者cba或者bca;
(2)稀盐酸能和氢氧化钠、碳酸钠反应,蒸发时可以得到氯化钠的饱和溶液,将滤液的pH调至酸性除去的离子是OH-、CO32-,
故答案为:OH-、CO32-;
(3)和电源的负极相连的是电解池的阴极,该电极上的电极反应为:2H++2e-=H2↑,氢离子浓度减小,所以碱性增强,酚酞变红,和电源的正极相连的是阳极,该机反应式为:2Cl--2e-=Cl2↑,检验氯气的方法为:将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生,根据两极上的电极反应可以得到总反应为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2H++2e-=H2↑;有无色气泡产生,溶液变红;2Cl--2e-=Cl2↑;将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生;2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(4)分离出NaHCO3晶体后的母液中含有氯化铵,加入过量生石灰后,氧化钙和水反应生成氢氧化钙,氢氧化钙和氯化铵反应能生成氯化钙、水和氨气,氨气可以循环使用,化学式是NH3,
故答案为:NH3;
(5)pH为11碳酸钠溶液中:C(H+)剩余•C(OH-)水=10-14;C(OH-)水=10-3mol/L,Na2CO3溶液中加入过量石灰乳,反应生成碳酸钙和氢氧化钠,所得溶液pH=13,则此时水电离出的c(OH-)的值是10-13mol/L,所以反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是$\frac{1{0}^{-3}mol/L}{1{0}^{-13}mol/L}$=1×1010,
故答案为:1×1010.
点评 本题考查了粗盐的提纯、电解原理,水的离子积的计算,题目难度中等,注意掌握粗盐的提纯方法,明确电解原理,能够正确判断电极反应、书写电极反应式,本题是一道实验探究综合题,对训练学生良好地思维品质以及知识的严密性有较好的帮助.

| A. | 葡萄糖 | B. | 油脂 | C. | 苯 | D. | 乙烯 |
| A. | 苯酚与碳酸钠反应:2C6H5OH+CO32-→2C6H5O-+CO2↑+H2O | |
| B. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| D. | SO2通入溴水中:SO2+2H2O+Br2═2H++SO42-+2HBr |
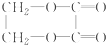 )所经历的反应的正确顺序是( )
)所经历的反应的正确顺序是( )①氧化 ②消去 ③加成 ④酯化 ⑤水解 ⑥加聚.
| A. | ①⑤②③④ | B. | ①②③⑤④ | C. | ②③⑤①④ | D. | ②③⑤①⑥ |
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | H2、I2、HI平衡混合气减小压强(扩大体积)可使颜色变浅 | |
| C. | 打开汽水瓶盖,有气泡冒出 | |
| D. | 在合成氨的反应中,加压有利于氨的合成 |
| A. | 乙醇 | B. | 氯化铵 | C. | 过氧化钠 | D. | 氯化镁 |
| A. | CH3COOH→CH3COOC2H5 | B. | C2H5Cl→CH2=CH2 | ||
| C. | 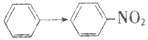 | D. | CH3CHO→C2H5OH |
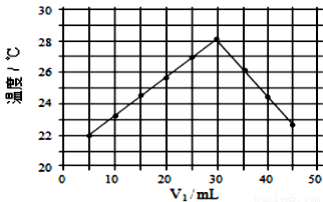
 V2=50ml)。下列叙述正确的是( )
V2=50ml)。下列叙述正确的是( )