题目内容
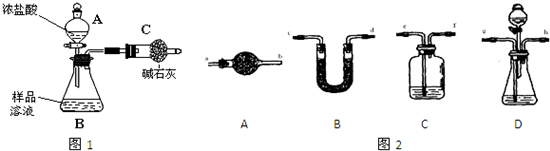
已知某纯碱样品中含有NaCl杂质,为测定样品中纯碱的质量分数,甲同学用如图1所示装置及试剂进行实验
(夹持仪器略).

(1)仪器A、B的名称分别是______、______.
(2)甲同学按实验正常操作的主要步骤如下:
①______;
②将a g试样放入仪器B中,加适量蒸馏水溶解,得到样品溶液;
③称量盛有碱石灰的干燥管的质量为b g;
④从仪器A中滴入浓盐酸,直到不再产生气体时为止;
⑤再次称量盛有碱石灰的干燥管的质量为c g;
(3)甲同学根据以上实验求得的样品中Na2CO3的质量分数是______(用含a、b、c的式子表示).
(4)乙同学认为甲同学在实验装置设计和使用药品上都有缺陷,会导致测得的Na2CO3的质量分数偏高,而丙同学则认为甲同学的实验装置会使测得的结果偏低,丙同学认为结果偏低的原因是:______.
(5)若要解决乙、丙同学指出的甲同学实验中的问题,可对甲同学的实验装置和实验药品进行适当的改动,请按合理顺序选择如图2所示仪器并完成下表:(用大写字母代表仪器,仪器可重复使用,夹持仪器略)
| 选用的仪器 | ______ | ______ | ______ | ______ | ______ |
| 添加的药品 (必要的操作) | ______ | ______ | ______ | ______ | ______ |
解:(1)仪器A、B的名称分别是:分液漏斗、锥形瓶,故答案为:分液漏斗;锥形瓶;
(2)①实验开始前需要检查装置的气密性,再连接好装置,
故答案为:检查装置气密性,连接好装置;
(3)根据碳酸钙和盐酸反应关系式CO2~Na2CO3,二氧化碳的物质的量等于碳酸钙的物质的量,二氧化碳的质量是:(c-b)g,物质的量是: mol,碳酸钙的质量分数是:
mol,碳酸钙的质量分数是: =
= ,
,
故答案为: ;
;
(4)碳酸钙生成的二氧化碳,部分存在于B装置中,不会完全被碱石灰吸收,
故答案为:二氧化碳没有完全被碱石灰吸收;
(5)按照从左向右的顺序,装置分别是C、D、C、B、A,C中装有氢氧化钠溶液,将通入的空气中的二氧化碳除掉,保证装置的生成的二氧化碳完全被碱石灰吸收;
D装置中分液漏斗中选用稀硫酸,避免挥发;C中装有浓硫酸,用于干燥二氧化碳,避免水分干扰;B装置中装有碱石灰,用于测定生成的二氧化碳质量;D装置装有碱石灰,用于吸收空气中的二氧化碳和水,避免影响B中质量,
故答案为:
| 选用的仪器 | C | D | C | B | A |
| 添加的药品 (必要的操作) | 装有氢氧化钠溶液,从e通入空气 | 分液漏斗装稀硫酸,锥形瓶内装样品溶液 | 浓硫酸 | 碱石灰,反应前后分别称量质量 | 碱石灰 |
分析:(1)根据常见仪器完成:A是分液漏斗,B是锥形瓶;
(2)①实验前需要检查装置气密性;
(3)根据碱石灰的质量差计算出二氧化碳的物质的量,根据碳酸钙的物质的量就等于二氧化碳的物质的量,计算出碳酸钙的质量分数;
(4)从二氧化碳变化完全被碱石灰吸收考虑;
(5)根据将装置中生成的二氧化碳利用空气赶走,保证生成的二氧化碳完全被碱石灰吸收原则进行选择.
点评:解答此类题型的关键是分析实验目的和探究方法,本题实验是通过生成的二氧化碳的质量来测定碳酸钠样品的成分含量,所以实验的成败在于收集的二氧化碳的质量是否准确.

 NaCl杂质,为测
NaCl杂质,为测
 可重复使用,夹持仪器略)
可重复使用,夹持仪器略)

