题目内容
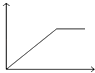
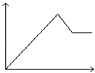
【题目】已知(HF)2(g)2HF(g),△H>0,且平衡体系的总质量[m(总)]与总物质的量[n(总)]之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( ) 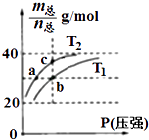
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:Vb>Va
D.当 ![]() =30g/mol时,n(HF):n(HF)2=2:1
=30g/mol时,n(HF):n(HF)2=2:1
【答案】C
【解析】解:A、根据平衡体系的总质量[m(总)]与总物质的量[n总]之比为混合气体平均摩尔质量,反应是吸热反应,升温平衡正向进行,气体物质的量增大,总质量[m(总)]与总物质的量[n总]之比减小分析,T1>T2,故A错误;
B、平衡常数随温度变化,不随压强变化,温度越高,平衡正向进行,平衡常数增大,平衡常数:K(a)=K(c)<K(b),故B错误;
C、分析判断可知T1>T2,温度越高反应速率越快,反应速率:Vb>Va,故C正确;
D、设n(HF):n[(HF)2]=x:y,根据 ![]() =
= ![]() =30g/mol,得x:y=1:1,故D错误;
=30g/mol,得x:y=1:1,故D错误;
故选C.
A、根据平衡体系的总质量[m(总)]与总物质的量[n总]之比为混合气体平均摩尔质量,反应是吸热反应,升温平衡正向进行,气体物质的量增大,总质量[m(总)]与总物质的量[n总]之比减小分析;
B、平衡常数随温度变化,不随压强变化;
C、依据温度对化学反应速率的影响判断;
D、根据 ![]() 的值,可计算出混合体系中n(HF)与n(HF)2的比值并判断.
的值,可计算出混合体系中n(HF)与n(HF)2的比值并判断.

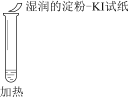
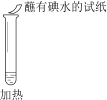
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化