题目内容
4.SO2和NOx都是大气污染物.(1)空气中的NO2可形成硝酸型酸雨,该反应的化学方程式是3NO2+H2O=2HNO3+NO.
(2)利用氨水可以将SO2和NO2吸收,原理如图所示:
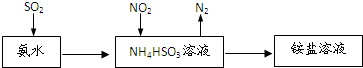
SO2被吸收的化学方程式是NH3.H2O+SO2=NH4HSO3.
NO2被吸收的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+.
分析 (1)二氧化氮与水反应生成硝酸和一氧化氮;
(2)二氧化硫与氨水反应生成亚硫酸氢铵;
二氧化氮具有强的氧化性,能够氧化亚硫酸氢根离子生成硫酸根离子,二氧化氮被还原为氮气.
解答 解:(1)二氧化氮与水反应生成硝酸和一氧化氮,化学方程式:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(2)二氧化硫与氨水反应生成亚硫酸氢铵,离子方程式:NH3.H2O+SO2=NH4HSO3;
二氧化氮具有强的氧化性,能够氧化亚硫酸氢根离子生成硫酸根离子,二氧化氮被还原为氮气,离子方程式:2NO2+4HSO3-=N2+4SO42-+4H+;
故答案为:NH3.H2O+SO2=NH4HSO3;2NO2+4HSO3-=N2+4SO42-+4H+.
点评 本题考查了化学方程式、离子方程式的书写,明确二氧化硫、二氧化氮的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
15.2009年8月15日~12月15日,公安部在全国开展为期四个月的严厉整治酒后驾驶交通违法行为专项行动,在执法中,交警用装有重铬酸钾[K2Cr2O7]的仪器检测司机是否酒后开车,因为酒中的乙醇分子可以使橙红色的重铬酸钾变成绿色的硫酸铬[Cr2(SO4)3].下列有关重铬酸钾的说法中正确的是( )
| A. | 铬元素的化合价为+7价 | B. | 在检查时重铬酸钾发生氧化反应 | ||
| C. | 重铬酸钾具有强氧化性 | D. | 它由橙红色变为绿色是物理变化 |
9.下列反应的离子方程式书写正确的是( )
| A. | 碳酸钠溶液与稀盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| B. | 氧化镁中加稀盐酸:2H++MgO═H2O+Mg2+ | |
| C. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| D. | 氢氧化钡溶液与硫酸溶液混合 Ba2++SO42-═BaSO4 |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是(相对原子质量:C 12 H 1 O 16 )( )
| A. | 标准状况下,22.4L乙醇中含有的碳原子数目为2NA | |
| B. | 78g 苯含有碳碳双键的数目为3NA | |
| C. | 1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA | |
| D. | 28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
13.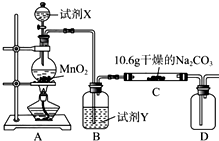 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
(1)装置A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置B中试剂Y应为饱和食盐水.
(3)该实验装置中明显存在不足之处,改进的措施为在装置D后连接一尾气处理装置.
(4)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.现对C中的成分进行猜想和探究.
①提出合理假设.
假设一:存在两种成分,为NaHCO3和NaCl;
假设二:存在三种成分,为NaHCO3和NaCl、Na2CO3.
②设计方案并实验.请在表格中写出实验步骤以及预期现象和结论.
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
结论:由步骤3的结论结合步骤2中的a,则假设一成立;由步骤3的结论结合步骤2中的b,则假设二成立.
(5)已知C中有0.1mol Cl2参加反应.若假设一成立,可推知C中反应生成的含氯氧化物为Cl2O(写化学式).
 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.(1)装置A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置B中试剂Y应为饱和食盐水.
(3)该实验装置中明显存在不足之处,改进的措施为在装置D后连接一尾气处理装置.
(4)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.现对C中的成分进行猜想和探究.
①提出合理假设.
假设一:存在两种成分,为NaHCO3和NaCl;
假设二:存在三种成分,为NaHCO3和NaCl、Na2CO3.
②设计方案并实验.请在表格中写出实验步骤以及预期现象和结论.
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
结论:由步骤3的结论结合步骤2中的a,则假设一成立;由步骤3的结论结合步骤2中的b,则假设二成立.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液(填写所加试剂即可) | b.若溶液变浑浊,证明固体中含有NaCl |

 .
.