题目内容
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C 表示10s内反应的平均反应速率为____________。
(2)反应前A的物质的量浓度是_______________。
(3)10s末,生成物D的浓度为______________________。
(4)A 平衡转化率______________。
【答案】0.04mol/(L·s) 1.5mol/L 0.4mol/L 40%
【解析】
根据三段式解题: 3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
起始浓度(mol/L) 1.5 0.5 0 0
变化浓度(mol/L) 0.6 0.2 0.4 0.4
平衡浓度(mol/L) 0.9 0.3 0.4 0.4
(1)10s末,C的物质的量为0.8mol,所以用C表示的正反应的化学反应速率为v(C)=![]() =
=![]() =0.04mol/(L·s),故答案为:0.04mol/(L·s)。
=0.04mol/(L·s),故答案为:0.04mol/(L·s)。
(2)10s末,达到平衡,测得A的物质的量为1.8mol,C的物质的量为0.8mol,由反应的化学计量数之比可知,反应前A的物质的量浓度为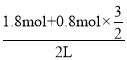 =1.5mol/L,故答案为:1.5mol/L。
=1.5mol/L,故答案为:1.5mol/L。
(3)由C、D的化学计量数之比可知平衡后生成的D的物质的量也为0.8mol,所以其浓度为![]() =0.4mol/L,故答案为:0.4mol/L。
=0.4mol/L,故答案为:0.4mol/L。
(4)A的平衡转化率为![]() ×100%=40%,故答案为:40%。
×100%=40%,故答案为:40%。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目