题目内容
对于反应3Cl2+6NaOH ==5NaCl+NaClO3+3H2O,以下叙述不正确的是
[ ]
A.NaClO3中Cl的化合价是+5
B.被氧化的Cl原子和被还原的Cl原子的物质的量的比为1∶5
C.Cl2既是氧化剂又是还原剂
D.每生成1mol的NaClO3转移6mol的电子
B.被氧化的Cl原子和被还原的Cl原子的物质的量的比为1∶5
C.Cl2既是氧化剂又是还原剂
D.每生成1mol的NaClO3转移6mol的电子
D

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
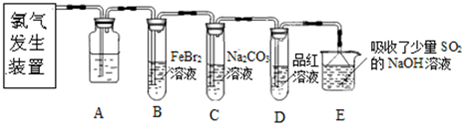
 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是