题目内容
2.某工厂排放的工业废水中可能含有K+、Al3+、NH4+、Mg2+、SO42-、Cl-、NO3-、HCO3-等离子.经检测废水呈明显的碱性,则可确定该厂废水中肯定不大量含有的离子组合是( )| A. | Al3+、NH4+、Mg2+、HCO3- | B. | K+、NH4+、NO3-、SO42- | ||
| C. | Al3+、K+、NO3-、HCO3- | D. | K+、Mg2+、SO42-、Cl- |
分析 废水呈明显的碱性,则含有大量的OH-,与某些阳离子结合生成沉淀或弱电解质不能共存,则阳离子一定存在K+,且能与HCO3-反应,以此来解答.
解答 解:因废水呈明显的碱性,则含有大量的OH-,
OH-能分别与HCO3-、Al3+、NH4+、Mg2+反应,
则溶液中一定不存在HCO3-、Al3+、NH4+、Mg2+,
故选A.
点评 本题考查离子的共存,为高频考点,明确溶液显碱性及氢氧根离子与常见离子的反应即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.滥用药物有碍健康.下列有关用药的叙述正确的是( )
| A. | 长期大量服用阿司匹林可预防感冒 | |
| B. | 运动员长期服用麻黄碱可提高成绩 | |
| C. | 注射青霉素前要先做皮肤敏感试验 | |
| D. | 胃溃疡患者服用碳酸氢钠中和过多胃酸 |
17.下列事故处理或操作不正确的是( )
| A. | 不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖 | |
| B. | 不慎将浓硫酸溅到皮肤上,应先用布抹去,再用大量水冲洗,最后涂上碳酸氢钠溶液 | |
| C. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,应先向烧瓶中加入几片碎瓷片 | |
| D. | 实验室制取氧气完毕后,应停止加热,再取出集气瓶,最后取出导气管 |
14.25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
| A. | 向水中加入少量固体NaHSO4,c(H+)增大,KW不变 | |
| B. | 向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)减小 | |
| C. | 向水中加入少量冰醋酸,平衡正向移动,c(H+) 增大 | |
| D. | 将水加热,KW增大,pH不变 |
11.1L 1mol•L-1 Na2SO4溶液中,下列各量正确的是( )
| A. | c(Na+)=1mol•L-1 | B. | n(Na+)=3mol | C. | c(SO42-)=2mol•L-1 | D. | m(Na2SO4)=142g |
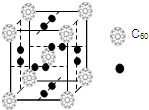 科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.