题目内容
用NA表示阿伏加德罗常数,下列说法正确的是:
| A.用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA |
| B.13gNO2和33gN2O4混合气体中含N原子数为NA |
| C.28gCO和22.4LN2含有的分子数均为NA |
| D.等物质的量的NH4+和OH-含电子数均为10NA |
B
解析试题分析:A、Fe(OH)3胶体中胶粒是大量Fe(OH)3分子的集合体,用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数小于0.1NA,错误;B、NO2和N2O4的最简式均为NO2,46gNO2和N2O4混合气体中含最简式的物质的量为1mol,N原子数为NA,正确;C、缺少条件标准状况,无法确定22.4LN2含有的分子数,错误;D、NH4+和OH-物质的量不确定,所含电子数不确定,错误。
考点:考查阿伏伽德罗常数及相关计算。

练习册系列答案
相关题目
碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,恰好消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是( )
| A.35g | B.30 g | C.20 g | D.15 g |
下列化学用语的表述不正确的是
| A.过氧化氢的结构式:H—O—O—H |
| B.2,2-二甲基丁烷的实验式:C3H7 |
C.质子数与中子数相等的氢原子符号: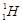 |
D.Cl-的结构示意图: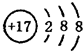 |
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA |
| B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
| C.1.0L的0.1 mol·L-1Na2S溶液中含有的S2-离子数为0.1NA |
| D.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A.1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA |
| B.标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA |
| C.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA |
| D.t℃时,MgCO3的KSP=4×10-6,,则饱和溶液中含Mg2+数目为2×10-3NA |
现有两份体积相同的混合溶液,其组成如下:
| | KCl | K2SO4 | ZnSO4 | ZnCl2 |
| (1) | 0.4 mol | 0.1mol | 0.3mol | 0.1mol |
| (2) | 0.2mol | 0.2mol | 0.1mol | 0.1mol |
则两份溶液中各离子浓度( )
A. 仅c(K+)相同 B. 仅c(Cl-)相同 C. 完全相同 D. 完全不同
向22.4g的Fe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液600mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
| A.6.4g | B.4.8g | C.2.4g | D.1.6g |
下列说法正确的是
| A.2.24 L CO2中含有的原子数为0.3×6.02×1023 |
| B.1.8 g NH4+ 含有的质子数为6.02×1023 |
| C.30 g乙酸和甲酸甲酯的混合物中含有的共价键数为4×6.02×1023 |
| D.7.8 g Na2O2中含有的阴离子数为0.2×6.02×1023 |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B.常温下,10LpH=13的NaOH溶液中含有的OH-离子数为NA |
| C.标准状况下,11.2L己烷中含有分子的数目为0.5NA |
| D.100mL0.1mol·L-1的FeCl3溶液中含有Fe3+的个数为0.01 NA |