题目内容
硫酸是一种实验室常用的化学试剂.请按要求填空:
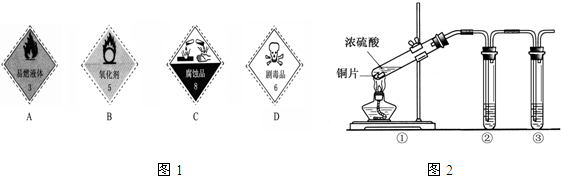
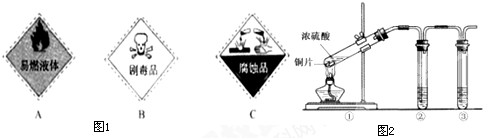
(1)浓硫酸试剂瓶上适合贴上的图标是图1中的 (填写字母标号).
(2)实验室有1.00mol?L-1的硫酸溶液,从中准确量出10.00mL,其物质的量浓度为 mol?L-1.现将准确量出的10.00mL的硫酸溶液配制成0.100mol?L-1的稀硫酸,所需要的玻璃仪器除烧杯、玻璃棒还需 和 .在配制过程中定容时俯视,则所配溶液浓度 (填“偏大”或“偏小”或“无影响”)
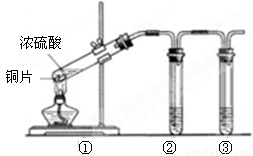
(3)用图2所示的实验装置②验证铜与浓硫酸反应生成的气体产物,则装置②、③中试剂依次为下列的 和
A.品红溶液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
(4)装置①中发生反应的化学方程式为 若装置①中加入铜6.4g和含有0.2molH2SO4的浓硫酸,则产生二氧化硫质量
A.等于6.4克 B.大于6.4克 C.小于6.4克 D.不能确定
(5)若将装置①中的铜片换成木炭,装置②试管内为氢硫酸溶液,装置③试管内为澄清石灰水,则装置①中发生反应的化学方程式为 .装置②中主要反应的氧化剂和还原剂物质的量之比是 .根据装置③观察到有白色沉淀生成的现象 (填“能”或“不能”)判断该白色沉淀一定只有CaCO3.
(1)浓硫酸试剂瓶上适合贴上的图标是图1中的
(2)实验室有1.00mol?L-1的硫酸溶液,从中准确量出10.00mL,其物质的量浓度为
(3)用图2所示的实验装置②验证铜与浓硫酸反应生成的气体产物,则装置②、③中试剂依次为下列的
A.品红溶液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
(4)装置①中发生反应的化学方程式为
A.等于6.4克 B.大于6.4克 C.小于6.4克 D.不能确定
(5)若将装置①中的铜片换成木炭,装置②试管内为氢硫酸溶液,装置③试管内为澄清石灰水,则装置①中发生反应的化学方程式为

分析:(1)浓硫酸具有腐蚀性;
(2)根据溶液为稳定、均一的分散系计算浓度;配制溶液时用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管以及容量瓶等仪器,在配制过程中定容时俯视,会导致溶液体积偏小;
(3)铜和浓硫酸反应生成二氧化硫,结合二氧化硫的性质解答;
(4)铜和浓硫酸在加热条件下发生氧化还原反应,随着反应的进行,硫酸浓度逐渐降低,稀硫酸和铜不反应;
(5)碳和浓硫酸在加热条件下发生氧化还原反应生成二氧化碳和二氧化硫,二氧化硫和硫化氢发生氧化还原反应生成硫.
(2)根据溶液为稳定、均一的分散系计算浓度;配制溶液时用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管以及容量瓶等仪器,在配制过程中定容时俯视,会导致溶液体积偏小;
(3)铜和浓硫酸反应生成二氧化硫,结合二氧化硫的性质解答;
(4)铜和浓硫酸在加热条件下发生氧化还原反应,随着反应的进行,硫酸浓度逐渐降低,稀硫酸和铜不反应;
(5)碳和浓硫酸在加热条件下发生氧化还原反应生成二氧化碳和二氧化硫,二氧化硫和硫化氢发生氧化还原反应生成硫.
解答:解:(1)浓硫酸具有腐蚀性,适合贴上的图标是图1中的C,故答案为:C;
(2)溶液为稳定、均一的分散系,则实验室有1.00mol?L-1的硫酸溶液,从中准确量出10.00mL,其物质的量浓度应仍为1.00mol?L-1,配制溶液时用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管以及容量瓶等仪器,在配制过程中定容时俯视,会导致溶液体积偏小,则浓度偏大,
故答案为:1.00;胶头滴管;100mL容量瓶;偏大;
(3)铜和浓硫酸反应生成二氧化硫,二氧化硫具有漂白性,可先后品红检验,因二氧化硫有毒,不能排放到空气中,可用氢氧化钠吸收,故答案为:A;C;
(4)铜和浓硫酸在加热条件下发生氧化还原反应,反应的方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度逐渐降低,稀硫酸和铜不反应,则生成的二氧化硫小于0.1mol,质量小于6.4g,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;C;
(5)碳和浓硫酸在加热条件下发生氧化还原反应生成二氧化碳和二氧化硫,反应的方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,硫化氢和二氧化硫发生:2H2S+SO2=3S↓+2H2O,由方程式可知,氧化剂和还原剂的物质的量之比是1:2,反应生成的CO2和SO2都可与澄清石灰水反应生成沉淀,则沉淀不一定为CaCO3,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;1:2;不能.
(2)溶液为稳定、均一的分散系,则实验室有1.00mol?L-1的硫酸溶液,从中准确量出10.00mL,其物质的量浓度应仍为1.00mol?L-1,配制溶液时用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管以及容量瓶等仪器,在配制过程中定容时俯视,会导致溶液体积偏小,则浓度偏大,
故答案为:1.00;胶头滴管;100mL容量瓶;偏大;
(3)铜和浓硫酸反应生成二氧化硫,二氧化硫具有漂白性,可先后品红检验,因二氧化硫有毒,不能排放到空气中,可用氢氧化钠吸收,故答案为:A;C;
(4)铜和浓硫酸在加热条件下发生氧化还原反应,反应的方程式为Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(5)碳和浓硫酸在加热条件下发生氧化还原反应生成二氧化碳和二氧化硫,反应的方程式为C+2H2SO4(浓)
| ||
故答案为:C+2H2SO4(浓)
| ||
点评:本题综合考查浓硫酸的性质,侧重于学生的分析能力、计算能力和实验能力的考查,为高考常见题型和高频考点,注意把握浓硫酸的性质,难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目