题目内容
16.用质量分数为98%,密度为1.84g/cm3的浓硫酸来配置500ml,0.2mol/L的稀硫酸.可供选择①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙.请回答下列问题:(1)上述仪器中,在配制稀硫酸时用不到的有 (填代号)②⑦⑧.
(2)经计算,需浓硫酸的体积为 mL(保留一位小数)5.4mL.
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到500 mL的容量瓶中,转移时应用玻璃棒引流.转移完毕,用少量蒸馏水洗涤烧杯和玻璃棒 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近瓶颈刻度1-2 cm处,改用胶头滴管滴加蒸馏水,使凹液面与刻度线相切.塞上瓶塞、摇匀后,把溶液倒入试剂瓶、贴上标签.
(4)定容时,俯视刻度线,所配溶液的物质的量浓度将偏高(选填“偏高”、“偏低”或“不变”).
分析 (1)根据配制溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容和摇匀来分析所需的仪器;
(2)计算出浓硫酸的物质的量浓度c=$\frac{1000ρω}{M}$,然后根据稀释定律来分析;
(3)配制500mL溶液,应选用500mL容量瓶,移液时要用玻璃棒引流;移液完成后,要用蒸馏水洗涤烧杯和玻璃棒2-3次,洗涤液也注入容量瓶中,然后直接向容量瓶中注入水至液面离刻度线1-2cm处,然后改用胶头滴管加水,至凹液面与刻度线相切.
(4)俯视刻度线,会导致溶液体积偏小.
解答 解:(1)根据配制溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容和摇匀可知所需的仪器有量筒、烧杯、玻璃棒、500ml容量瓶和胶头滴管,故用不到的仪器有②⑦⑧,故答案为:②⑦⑧;
(2)浓硫酸的物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要的浓硫酸的体积为VmL,根据稀释定律可知:18.4mol/L×VmL=0.2mol/L×500mL,解得V=5.4mL,故答案为:5.4mL;
(3)由于容量瓶只有一条刻度线,故配制500mL溶液,应选用500mL容量瓶,移液时为了防止溶液溅出,要用玻璃棒引流;移液完成后,要用蒸馏水洗涤烧杯和玻璃棒2-3次,洗涤液也注入容量瓶中,然后直接向容量瓶中注入水至液面离刻度线1-2cm处,然后改用胶头滴管加水,至凹液面与刻度线相切,
故答案为:500;引流;烧杯和玻璃棒;1-2;胶头滴管;凹液面与刻度线相切;
(4)俯视刻度线,会导致溶液体积偏小,则溶液浓度偏高,故答案为:偏高.
点评 本题考查了一定物质的量浓度溶液的配制过程中的仪器的选择和操作步骤以及误差分析,属于基础性题目,难度不大.

| A. | 医用酒精和工业酒精的主要成分相同,都可用于伤口消毒 | |
| B. | 人体对食物中蛋白质的消化其实就是使蛋白质发生了水解 | |
| C. | 若两种二肽互为同分异构体,则两者的水解产物不一致 | |
| D. | 棉、麻、蚕丝、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| A. | $\frac{{W}_{x}}{N+x-n}$ mol | B. | $\frac{W(x-n)}{N+x-n}$ mol | C. | $\frac{W(x+n)}{N+x-n}$ mol | D. | $\frac{W(x+n)}{N+x+n}$ mol |
 NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺.
NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺.(1)NaClO溶液能杀菌消毒,原因之一是其溶液中存在有效氯(HClO),写出NaClO水解的离子方程式:ClO-+H2O
 HClO+OH-.
HClO+OH-.(2)NaClO溶液的杀菌效果与溶液的浓度、温度及溶液中存在的微粒有关.
①不同温度下,500mL 0.1mol?L-1NaClO溶液对1m3空间的杀菌效果如下表所示:
| 温度/℃ | 20 | 30 | 40 | 80 |
| 时间/min | 10 | 10 | 10 | 10 |
| 杀菌率 | 83% | 90% | 97% | 92% |
②下列微粒会减弱NaClO溶液消毒效果的是cd(填字母).
a.NH4+ b.ClO- c.OH- d.SO32-
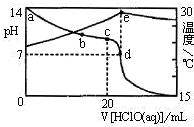
(3)室温下,将1.00mol?L-1的HClO滴入20.00mL 1.00mol?L-1NaOH溶液中,溶液的pH和温度随加入HClO体积的变化曲线如图所示.
①a、b、c、d四点中,水的电离程度最大的是c(填字母).
②下列说法中正确的是AB(填字母).
A.a、b、c、d四点溶液中d点溶液中ClO-的物质的量最大
B.c点溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+)
C.d点溶液中:c(Na+)=c(ClO-)+c(HClO)
D.e点后溶液温度下降的主要原因是HClO电离吸热.
| 名称 | 硫代硫酸钠 | 多硫化钙 | 过氧化钡 | 超氧化钾 |
| 化学式 | Na2S2O3 | CaSx | BaO2 | KO2 |
| A. | 三硫代碳酸钾 | B. | 多硫碳酸钾 | C. | 过硫碳酸钾 | D. | 超硫碳酸钾 |
| A. | 1.44 g | B. | 1.60 g | C. | 2.14 g | D. | 1.8 g |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 钢铁发生电化腐蚀的正极反应式:Fe-2e-=Fe2+ | |
| B. | 酸性条件下甲烷燃料电池的负极反应式:CH4+2H2O-8e-=CO2↑+8H+ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜 | |
| D. | 用活性电极电解饱和食盐水,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
 .
.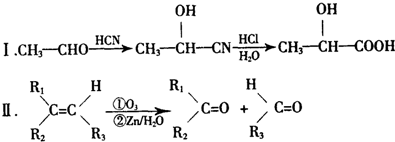
 ;反应类型:消去反应;
;反应类型:消去反应; $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$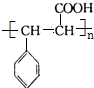 ;
;