题目内容
无水硫酸铜在强热下会发生分解反应:
CuSO4
CuO+SO3↑ 2SO3
2SO2↑+O2↑
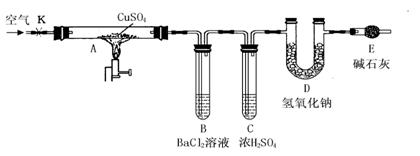
用如图所示装置(夹持仪器已略去),根据D管在反应前后的质量差计算出分解了的无水硫酸铜的质量.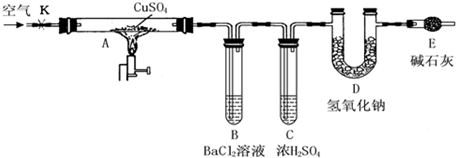
实验步骤:
①称量反应前D管的质量.
②连接好装置,关闭K,加热硬质玻璃管A一段时间后,停止加热.
③待硬质玻璃管A冷却后,打开K,通入一段时间的已除去二氧化碳等酸性气体的空气.
④再称量D管,得其反应前后的质量差为m.
回答下列问题:
(1)2SO3(g)
2SO2(g)+O2(g)该反应的平衡常数表达式为K= .
(2)B管中除温度明显升高外,还可看到的现象是 ,而温度明显升高的主要原因是 ;B管中发生反应的有关离子方程式是 .
(3)步骤③中通一段时间已除去二氧化碳等酸性气体的空气的目的是 .
(4)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算出分解了的无水CuSO4的质量?(任选其一回答)
①如果能,则分解的无水CuSO4的质量为 (用m表示).
②如果不能,则原因是 .为了能测得分解了的无水硫酸铜的质量,你的简单实验方案是 .
CuSO4
| ||
| △ |
用如图所示装置(夹持仪器已略去),根据D管在反应前后的质量差计算出分解了的无水硫酸铜的质量.

实验步骤:
①称量反应前D管的质量.
②连接好装置,关闭K,加热硬质玻璃管A一段时间后,停止加热.
③待硬质玻璃管A冷却后,打开K,通入一段时间的已除去二氧化碳等酸性气体的空气.
④再称量D管,得其反应前后的质量差为m.
回答下列问题:
(1)2SO3(g)
| △ |
(2)B管中除温度明显升高外,还可看到的现象是
(3)步骤③中通一段时间已除去二氧化碳等酸性气体的空气的目的是
(4)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算出分解了的无水CuSO4的质量?(任选其一回答)
①如果能,则分解的无水CuSO4的质量为
②如果不能,则原因是
分析:(1)依据化学平衡常数概念分析书写,用生成物浓度的幂次方乘积除以反应物的幂次方乘积;
(2)硫酸铜受热分解生成产物中含有三氧化硫、二氧化硫和氧气,所以B中会看到白色沉淀生成和气泡冒出;温度升高是三氧化硫溶于水生成硫酸放出的热量,硫酸和氯化钡反应生成硫酸钡沉淀;
(3)利用二氧化碳把三氧化硫、二氧化硫气体全部赶出到后续装置完全吸收分析;
(4)①无水硫酸铜在强热下会发生分解反应:CuSO4
CuO+SO3↑ 2SO3
2SO2↑+O2↑,若全部吸收完全,则D装置增重为二氧化硫的质量,依据化学方程式计算分解的硫酸铜质量;
②如果不能,则原因是SO3不能完全分解为SO2和O2;SO2会部分溶解在溶液中,为了能测得分解了的无水硫酸铜的质量,可以称量硫酸铜在加热前后的质量变化可以得到分解的硫酸铜质量.
(2)硫酸铜受热分解生成产物中含有三氧化硫、二氧化硫和氧气,所以B中会看到白色沉淀生成和气泡冒出;温度升高是三氧化硫溶于水生成硫酸放出的热量,硫酸和氯化钡反应生成硫酸钡沉淀;
(3)利用二氧化碳把三氧化硫、二氧化硫气体全部赶出到后续装置完全吸收分析;
(4)①无水硫酸铜在强热下会发生分解反应:CuSO4
| ||
| △ |
②如果不能,则原因是SO3不能完全分解为SO2和O2;SO2会部分溶解在溶液中,为了能测得分解了的无水硫酸铜的质量,可以称量硫酸铜在加热前后的质量变化可以得到分解的硫酸铜质量.
解答:解:(1)2SO3(g)
2SO2(g)+O2(g)该反应的平衡常数表达式为K=
,故答案为:
;
(2)硫酸铜受热分解生成产物中含有三氧化硫、二氧化硫和氧气,所以B中会看到白色沉淀生成和气泡冒出;温度升高是三氧化硫溶于水生成硫酸放出的热量,硫酸和氯化钡反应生成硫酸钡沉淀,反应的离子方程式为SO3+H2O+Ba2+=BaSO4↓+2H+或SO3+H2O=2H++SO42-和Ba2++SO42-=BaSO4↓,
故答案为:有气泡冒出,产生白色沉淀;SO3溶于水放热;SO3+H2O+Ba2+=BaSO4↓+2H+或SO3+H2O=2H++SO42-和Ba2++SO42-=BaSO4↓;
(3)利用二氧化碳把三氧化硫、二氧化硫气体全部赶出到后续装置完全吸收分析,目的是使残留在装置中的SO2、SO3被充分吸收,
故答案为:使残留在装置中的SO2、SO3被充分吸收;
(4)①假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,如果能,则分解的无水CuSO4的质量可以依据化学方程式计算,无水硫酸铜在强热下会发生分解反应:CuSO4
CuO+SO3↑ 2SO3
2SO2↑+O2↑,2CuSO4~2SO2,则分解的硫酸铜质量=
×160g/mol=2.5mg,
故答案为:2.5mg;
②如果不能,则原因是SO3不能完全分解为SO2和O2;SO2会部分溶解在溶液中,为了能测得分解了的无水硫酸铜的质量,可以称量硫酸铜在加热前后的质量变化可以得到分解的硫酸铜质量,
故答案为:SO3不能完全分解为SO2和O2;SO2会部分溶解在溶液中;称量装有无水硫酸铜的A管质量,强热一段时间后,冷却后再称量A管质量,根据A管在反应前后的质量差计算出分解了的无水硫酸铜的质量.
| △ |
| c2(SO2)×c(O2) |
| c2(SO3) |
| c2(SO2)×c(O2) |
| c2(SO3) |
(2)硫酸铜受热分解生成产物中含有三氧化硫、二氧化硫和氧气,所以B中会看到白色沉淀生成和气泡冒出;温度升高是三氧化硫溶于水生成硫酸放出的热量,硫酸和氯化钡反应生成硫酸钡沉淀,反应的离子方程式为SO3+H2O+Ba2+=BaSO4↓+2H+或SO3+H2O=2H++SO42-和Ba2++SO42-=BaSO4↓,
故答案为:有气泡冒出,产生白色沉淀;SO3溶于水放热;SO3+H2O+Ba2+=BaSO4↓+2H+或SO3+H2O=2H++SO42-和Ba2++SO42-=BaSO4↓;
(3)利用二氧化碳把三氧化硫、二氧化硫气体全部赶出到后续装置完全吸收分析,目的是使残留在装置中的SO2、SO3被充分吸收,
故答案为:使残留在装置中的SO2、SO3被充分吸收;
(4)①假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,如果能,则分解的无水CuSO4的质量可以依据化学方程式计算,无水硫酸铜在强热下会发生分解反应:CuSO4
| ||
| △ |
| mg |
| 64g/mol |
故答案为:2.5mg;
②如果不能,则原因是SO3不能完全分解为SO2和O2;SO2会部分溶解在溶液中,为了能测得分解了的无水硫酸铜的质量,可以称量硫酸铜在加热前后的质量变化可以得到分解的硫酸铜质量,
故答案为:SO3不能完全分解为SO2和O2;SO2会部分溶解在溶液中;称量装有无水硫酸铜的A管质量,强热一段时间后,冷却后再称量A管质量,根据A管在反应前后的质量差计算出分解了的无水硫酸铜的质量.
点评:本题考查了物质反应产物的实验分析设计,实验测定的步骤分析判断,生成物的性质分析应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
 CuO + SO3↑ 2SO3
CuO + SO3↑ 2SO3  2SO2↑+ O2↑
2SO2↑+ O2↑
 2SO2(g) + O2(g) 该反应的平衡常数表达式为K= 。
2SO2(g) + O2(g) 该反应的平衡常数表达式为K= 。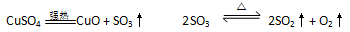
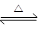 2SO2(g)
+ O2(g) 该反应的平衡常数表达式为K= 。
2SO2(g)
+ O2(g) 该反应的平衡常数表达式为K= 。