题目内容
已知:CO(g)+H2O(g)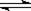 CO2(g)+H2(g) △H= -42kJ·mol-1
CO2(g)+H2(g) △H= -42kJ·mol-1
(1)在一定温度下,向一定体积的密闭容器中通入1molCO、2molH2O(g),反应达平衡时,测得放出的热量为28kJ,求CO的转化率为 ;
(2)该温度下,向该密闭容器中通入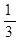 molCO2、
molCO2、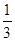 molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是
;
molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是
;
(3)该温度下,向该密闭容器中通入2molCO、3molH2O(g),反应达平衡时时,求H2O(g)的转化率 ;
(4)该温度下,向该密闭容器中通入1.5molCO、3molH2O(g),反应达平衡时,放出的热量为 kJ。
【答案】
(1)66.7%(2分)
(2)向容器中通入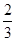 mol CO 、
mol CO 、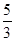 mol H2O(g)(2分)
mol H2O(g)(2分)
(3)40%(2分)
(4)42(2分)
【解析】

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(2013?西城区一模)已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
| ||||||||||||||||||||||
已知:①CO(g)+
O2(g)═CO2(g)△H=-283.0kJ?mol-1②H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1,则CO(g)+H2O(g)═H2(g)+CO2(g)的△H为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、+41.2 kJ?mol-1 |
| B、-41.2 kJ?mol-1 |
| C、+82.4kJ?mol-1 |
| D、-524.8 kJ?mol-1 |

 (2010?西城区模拟)熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示:
(2010?西城区模拟)熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示: