题目内容
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
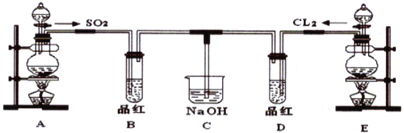
(1)写出Cu与浓硫酸制备SO2的化学方程式__________。
(2)实验室用装置E制备Cl2的离子方程式_________ 。指出该反应中HCl(浓)所表现出的化学性质__________、___________。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________的现象。
A品红都褪色 B品红都不褪色
C试管B 中品红褪色D 中不褪色 D试管D 中品红褪色B 中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象又分别为_____。
A 无色 红色 B 无色 无色 C 红色 红色 D 红色 无色
(4)C烧杯氢氧化钠溶液的作用是___________。
(5)另一个实验小组的同学认为SO2 和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________。
【答案】Cu + 2H2SO4(浓)![]() SO2↑+ 2H2O+ CuSO4 MnO2 + 4H+ +2Cl-
SO2↑+ 2H2O+ CuSO4 MnO2 + 4H+ +2Cl- ![]() Mn2+ +Cl2↑ +2H2O 酸性 还原性 A D 吸收过量的SO2和Cl2,防止污染环境 Cl2 + SO2 + 2H2O= 2HCl + H2SO4
Mn2+ +Cl2↑ +2H2O 酸性 还原性 A D 吸收过量的SO2和Cl2,防止污染环境 Cl2 + SO2 + 2H2O= 2HCl + H2SO4
【解析】
装置A是制备二氧化硫气体的发生装置,生成的二氧化硫具有漂白性,通入装置B中品红溶液褪色,装置E是制备氯气的发生装置,生成的氯气和水反应所处的次氯酸具有强氧化性,具有漂白性,通入品红溶液褪色,剩余二氧化硫和氯气被装置C中氢氧化钠溶液吸收,防止污染空气。
(1)Cu与浓硫酸制备SO2,同时生成硫酸铜和水,化学方程式Cu + 2H2SO4(浓)![]() SO2↑+ 2H2O+ CuSO4,故答案为:Cu + 2H2SO4(浓)
SO2↑+ 2H2O+ CuSO4,故答案为:Cu + 2H2SO4(浓)![]() SO2↑+ 2H2O+ CuSO4 ;
SO2↑+ 2H2O+ CuSO4 ;
(2)实验室用装置E制备Cl2,MnO2与浓盐酸反应生成氯化锰、水,离子方程式MnO2 + 4H+ +2Cl- ![]() Mn2+ +Cl2↑ +2H2O ,该反应中HCl(浓)中氯元素化合价部分升高,所表现出的化学性质酸性、还原性,故答案为:MnO2 + 4H+ +2Cl-
Mn2+ +Cl2↑ +2H2O ,该反应中HCl(浓)中氯元素化合价部分升高,所表现出的化学性质酸性、还原性,故答案为:MnO2 + 4H+ +2Cl- ![]() Mn2+ +Cl2↑ +2H2O ;酸性、还原性;
Mn2+ +Cl2↑ +2H2O ;酸性、还原性;
(3)①二氧化硫和氯气均具有漂白性,反应开始一段时间后,B、D两个试管中的品红溶液都褪色,故选A,故答案为:A;
②SO2的漂白具有可逆性,次氯酸的漂白不可逆,停止通气后,再给B、D两个试管分别加热,两个试管中的现象又分别为红色、无色,故选D,故答案为:D;
(4)装置C中 氢氧化钠可以吸收剩余的二氧化硫和氯气,防止污染环境,故答案为:除去多余的二氧化硫和氯气;
(5)氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者1:1发生反应:Cl2+SO2+2H2O═2HCl+H2SO4,生成物都无漂白性,因而SO2和Cl2按1:1同时通入到品红溶液时,品红溶液并不褪色,故答案为:Cl2+SO2+2H2O═2HCl+H2SO4.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。