题目内容
【题目】近年来,磁性材料的研究备受国际磁学界的关注。Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。回答下列问题:
(1)以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如图所示。
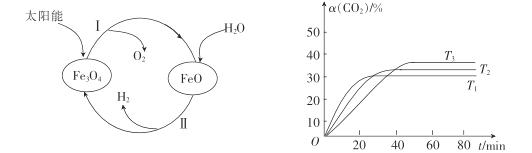
已知:H2O(l)= H2(g)+![]() O2(g)△H1+285.5kJ·mol-1
O2(g)△H1+285.5kJ·mol-1
过程I:2 Fe3O4(s)6 FeO (s)+O2(g)△H2=+313.2kJmol-1
则过程II的热化学方程式为 ______________________________。
(2)磁铁矿(Fe3O4)是工业上冶炼铁的原料之一,发生的主要反应为Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)△H <0,T℃ 时,在 1L 恒容密闭容器中加入Fe3O4、CO各0.5mol,5min反应达到平衡时,固体质量减小了6.4g。
①从起始到反应达到平衡时v(CO2)=______,T℃时,该反应的平衡常数K=________。
②欲提高该反应中 CO的平衡转化率,可采取的措施是______(任写一个即可)。
③其他条件不变时,该反应在不同温度下,CO2的产率随时间的变化α(CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是____,判断依据是_______。
【答案】3FeO(s)+H2O(1)= H2(g)+Fe3O4(s)△H=+128.9kJmo1-1 0.08mo1L-1 min-1 256 移出CO2(或降低温度) T1>T2>T3 其他条件相同时,曲线斜率T1>T2>T3,即反应速率v1>v2>v3,而温度越高,反应速率越快,所以T1>T2>T3[或该反应是放热反应,温度越高,达到平衡时α(CO2)越小或温度越高,达到平衡时所需时间越短]
【解析】
根据图中信息和盖斯定律书写热化学方程式并计算ΔH,根据固体减少的质量计算固体减少的物质的量,结合方程式计算CO2生成的物质的量,利用三段式计算反应的平衡常数,根据平衡移动原理判断提高平衡转化率的措施,根据“先拐先平”比较温度大小。
(1)根据图中信息可知,过程II的方程式为3FeO(s)+H2O(l)=H2(g)+Fe3O4(s),已知①H2O(1)=H2(g)+![]() O2(g)△H1=+285.5kJ·mol-1,②2Fe3O4(s)6FeO(s)+O2(g)△H2=+313.2kJ·mol-1,根据盖斯定律,由①-②×
O2(g)△H1=+285.5kJ·mol-1,②2Fe3O4(s)6FeO(s)+O2(g)△H2=+313.2kJ·mol-1,根据盖斯定律,由①-②×![]() 得反应3FeO(s)+H2O(l)=H2(g)+Fe3O4(s)△H=+285.5kJ·mol-1-313.2kJ·mol-1×
得反应3FeO(s)+H2O(l)=H2(g)+Fe3O4(s)△H=+285.5kJ·mol-1-313.2kJ·mol-1×![]() =+128.9kJ/mol;
=+128.9kJ/mol;
(2)①1L恒容密闭容器中加入Fe3O4、CO各0.5mol,5min反应达到平衡时,固体质量减小了6.4g,根据方程式可知,固体减少的质量即为4个O原子的质量,则有:
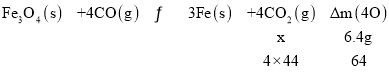
所以生成CO2的质量x=17.6g,即物质的量为0.4mol,所以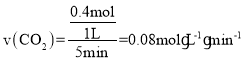 ,根据转化关系列三段式有:
,根据转化关系列三段式有:

所以平衡常数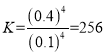 ;
;
②该反应为放热反应,欲提高该反应中CO的平衡转化率,则使平衡正向移动,可采取的措施是移出CO2或降低温变;
③由图像可知,其他条件相同时,曲线斜率T1>T2>T3,即反应速率v1>v2>v3,而温度越高,反应速率越快,所以T1>T2>T3[或该反应是放热反应,温度越高,达到平衡时α(CO2)越小或温度越高,达到平衡时所需时间越短]。