题目内容
二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-?H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系正确的是( )
分析:A、依据电离过程可知二元酸是弱酸,HA-离子水解显碱性,电离显酸性;
B、依据溶液中电荷守恒计算分析;
C、依据电离过程可知二元酸是弱酸,A2-水解显碱性;
D、溶液中存在电荷守恒;
B、依据溶液中电荷守恒计算分析;
C、依据电离过程可知二元酸是弱酸,A2-水解显碱性;
D、溶液中存在电荷守恒;
解答:解:A、二元酸H2A在水溶液中发生电离:H2A?H++HA-,HA-?H++A2-.说明是二元弱酸,HA-离子存在两种趋势,电离和水解,电离大于水解溶液显酸性,水解大于电离溶液显碱性,故A错误;
B、在NaHA溶液中存在阳离子是Na+、H+,阴离子HA-、A2-、OH-,溶液中存在物料守恒,c(Na+)=c(A2-)+c(HA-)故B正确;
C、在Na2A溶液中A2-离子水解溶液显碱性,A2-+H2O?HA-+OH-;HA-+H2O?H2A+OH-;溶液中离子浓度一定是:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),故B错误;
D、在H2A溶液中阳离子H+,阴离子HA-、A2-、OH-,溶液中存在电荷守恒一定是:c(H+)=c(HA-)+2c(A2-)+c(OH-),故D错误;
故选B.
B、在NaHA溶液中存在阳离子是Na+、H+,阴离子HA-、A2-、OH-,溶液中存在物料守恒,c(Na+)=c(A2-)+c(HA-)故B正确;
C、在Na2A溶液中A2-离子水解溶液显碱性,A2-+H2O?HA-+OH-;HA-+H2O?H2A+OH-;溶液中离子浓度一定是:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),故B错误;
D、在H2A溶液中阳离子H+,阴离子HA-、A2-、OH-,溶液中存在电荷守恒一定是:c(H+)=c(HA-)+2c(A2-)+c(OH-),故D错误;
故选B.
点评:本题考查了盐类水解的应用,离子浓度大小的比较,溶液中的电荷守恒应用,关键是酸式盐存在的电离和水解程度大小的确定.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(9分)某二元酸H2A在水中的电离方程式:H2A==H++HA-;HA- H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显 (填“酸性”、“中性”或“碱性”)。理由是
___________________________________________(用离子方程式表示)
(2)在0.1 mol/L的Na2A溶液中,下列离子浓度关系不正确的是 。
| A.c(A2-)+c(HA-)=0.1 mol/L |
| B.c(H+)=c(OH-)+c(HA-) |
| C.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
| D.c(Na+)=2c(A2-)+2c(HA-) |
 H++A2-
H++A2-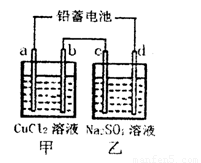
 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________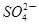 (aq)+4e-
(aq)+4e- PbSO4(s)+2H2O(1)
PbSO4(s)+2H2O(1) H++A2-,请回答下列问题:
H++A2-,请回答下列问题: