��Ŀ����
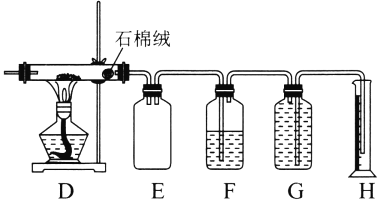
����Ŀ��50mL 0.50mol��L��1������50mL 0.55mol��L��1NaOH��Һ��ͼʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش������⣺
��1��ͼ����ȱ�ٵ�һ��������______��
��2��ʵ��ʱ���β�����������˶�������________��
a�������˶� ������ b�������˶� c��˳ʱ���˶� �� d����ʱ���˶�
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ_______���ƫ��ƫС������Ӱ�족����
��4������ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ��________�����ƫ��ƫС������Ӱ�족��
��5����������������Ӧ����1molˮ��������241.8kJ��д���÷�Ӧ���Ȼ�ѧ����ʽ��_______________����1gˮ����ת����Һ̬ˮ����2.444kJ����������ȼ����Ϊ_________kJ��mol��1������4λ��Ч���֣���
���𰸡��¶ȼ�aƫСƫС2H2��g��+O2(g ) =2H2O(g) ��H=-483.6 kJ��mol��1285.8
��������
��1���������ȼƵĹ������֪����װ�õ�ȱ���������¶ȼ�����������������������¶ȼ���
��2��ʵ��ʱ���β�����������˶������������˶�����������������ѡa��
��3�����ձ����粻��Ӳֽ��������һ��������ɢʧ����õ��к�����ֵ�����С���������������������ƫС��
��4����ˮΪ����,�������Ϊ���ȹ���,�����ð�ˮ����ϡ����������Һ��Ӧ,��Ӧ�ų�������ƫС�������������������:ƫС��
��5����������������Ӧ����1molˮ��������241.8kJ��������2 molˮ��������483.6kJ���÷�Ӧ���Ȼ�ѧ����ʽ��2H2��g��+O2(g ) =2H2O(g) ��H=-483.6 kJ��mol��1����1gˮ����ת����Һ̬ˮ����2.444kJ�� ��18gˮ����ת����Һ̬ˮ����44.0kJ����H2��g��+1/2O2(g ) =H2O(g) ��H=-241.8kJ��mol��1, H2��g��+1/2O2(g ) =H2O(l) ��H=-(241.8+44)= -285.8 kJ��mol��1����������ȼ����Ϊ285.8 kJ��mol��1������������������ǣ�2H2��g��+O2(g ) =2H2O(g) ��H=-483.6 kJ��mol��1 ��285.8��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���������ӷ���ʽ����д�����۾���������( )
ѡ�� | ���ӷ���ʽ | ���� |
A | ��2 mol Cl2ͨ�뺬1 mol FeI2����Һ�У� 2Fe2����2I����2Cl2===2Fe3����4Cl����I2 | ��ȷ��Cl2�������ɽ�Fe2����I�������� |
B | Ba(HCO3)2��Һ��������NaOH��Һ��Ӧ�� Ba2����HCO3-��OH��===BaCO3����H2O | ��ȷ����ʽ����Ӧ�������κ�ˮ |
C | ����SO2ͨ��NaClO��Һ�У� SO2��H2O��ClO��===HClO��HSO3- | ��ȷ��˵�����ԣ�H2SO3ǿ��HClO |
D | 1 mol/L��NaAlO2��Һ��2.5 mol/L��HCl��Һ�������ϣ� 2AlO2-��5H��===Al3����Al(OH)3����H2O | ��ȷ����һ����Ӧ�͵ڶ�����Ӧ���ĵ�H�������ʵ���֮��Ϊ2��3 |
A. A B. B C. C D. D