题目内容
【题目】过碳酸钠(Na2CO3·3H2O2) 在洗涤、纺织、医药等领域有广泛应用。一种制备过碳酸钠的工艺流程如图所示。
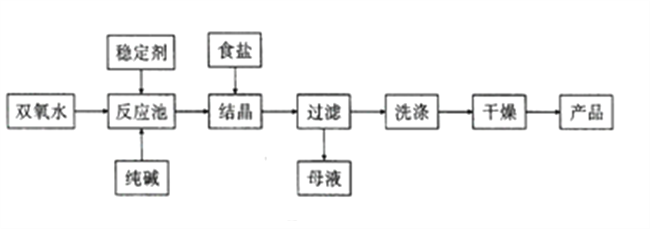
(1)碳酸钠水溶液呈碱性的原因是____________(用离子方程式表示),为增强洗涤效果,可采取最简单的措施是________________。
(2)过碳酸钠受热易分解,写出反应的化学方程式:__________________
(3)稳定剂可能是_____(填序号)。
A.Na2SO3 B.Na2SiO3 C.H2SO4 D.MnO2
(4)结晶时加入食盐的目的是_________,母液中可循环使用的物质是_________(填化学式)。
(5)工业上常以过碳酸钠产品中活性含氧量![]() 来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
【答案】 CO32-+H2O![]() HCO3-+OH- 加热 2(Na2CO3·3H2O2)
HCO3-+OH- 加热 2(Na2CO3·3H2O2) ![]() 2Na2CO3+6H2O+3O2↑ B 促进产品析出(或提高产率) NaCl [4c(V1-V2)/m]%
2Na2CO3+6H2O+3O2↑ B 促进产品析出(或提高产率) NaCl [4c(V1-V2)/m]%
【解析】(1)碳酸钠溶液水解显碱性,正确答案:CO32-+H2O![]() HCO3-+OH-;(写出第一步即可)
HCO3-+OH-;(写出第一步即可)
水解过程吸热,升高温度,平衡右移,碱性增强,去污能力增强,正确答案:加热;(2)由Na2CO3与H2O2复合而形成的一种固体放氧剂,受热分解生成碳酸钠、氧气、水,正确答案:2(Na2CO3·3H2O2) ![]() 2Na2CO3+6H2O+3O2↑
2Na2CO3+6H2O+3O2↑
(3)Na2SO3易被H2O2氧化为Na2SO4;H2SO4易与Na2CO3反应;MnO2能够加快H2O2的分解;Na2SiO3与Na2CO3或H2O2均不反应,可以做稳定剂;正确答案选B;
(4)结晶过程中加入氯化钠、搅拌,增加钠离子浓度,能降低过碳酸钠的溶解度,有利于过碳酸钠析出; “母液”中主要为氯化钠溶液,蒸发结晶后NaCl又可以重新利用;正确答案:促进产品析出(或提高产率);NaCl;
(5)酸性条件下高锰酸钾溶液氧化双氧水反应:2MnO4-+5H2O2+6H+=2Mn2++5O2+8H2O;根据题意可知,消耗高锰酸钾溶液的体积为V1-V2 mL=(V1-V2)×10-3L;根据反应关系式:2MnO4----5H2O2,c×(V1-V2)×10-3 :n(H2O2)=2:5,解之得:
n(H2O2)=2.5 c×(V1-V2)×10-3,带入公式:![]() ,进行计算,结果为
,进行计算,结果为
16×2.5 c×(V1-V2)×10-3÷m÷100%=[4c(V1-V2)/m]%;正确答案:[4c(V1-V2)/m]%。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】下表中物质的分类组合,完全正确的是( )
编号 | A | B | C | D |
强电解质 | KNO3 | H2SO4 | Na2SO4 | HClO4 |
弱电解质 | NH3·H2O | CaCO3 | HClO | C2H5OH |
非电解质 | SO2 | Al | H2O | CH3COOH |
A.AB.BC.CD.D


