题目内容
将某弱酸HA amol与其盐NaA bmol溶于水配成混合溶液,已知该混合溶液中c(H+)+c(HA)=c(Na+)+c(OH-),则对该溶液的分析错误的是
- A.若c(H+)>c(OH-),则c(A-) >c(HA)
- B.若c(H+)<c(OH-),则c(HA) >c(A-)
- C.a>b
- D.a=b
C
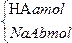
电荷守恒:c(H+)+c(Na+)=c(A-)+c(OH-)
已知 c(H+)+c(HA)=c(Na+)+c(OH-)
两式相减得:c(A-)+c(HA)=2c(Na+)

![]()
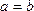
若溶液呈酸性,电离大于水解,则c(A-) >c(HA)
若溶液呈碱性,电离小于水解,c(HA) >c(A-)
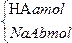
电荷守恒:c(H+)+c(Na+)=c(A-)+c(OH-)
已知 c(H+)+c(HA)=c(Na+)+c(OH-)
两式相减得:c(A-)+c(HA)=2c(Na+)
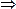

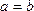
若溶液呈酸性,电离大于水解,则c(A-) >c(HA)
若溶液呈碱性,电离小于水解,c(HA) >c(A-)

练习册系列答案
相关题目