��Ŀ����
����Ŀ����������������̵���Ҫ������ͳ�������������ʵ���Һ�ҽ�����зdz��㷺��Ӧ�á���ͼ1�ǹ�ҵ�������̿�����Ҫ��MnO2���Ʊ�������ؾ����һ�ֹ������̣�

��1����������������Ӧ���������н��У������ô�������ԭ�������û�ѧ����ʽ��ʾ����д����Ӧ�������ӷ���ʽ��
��2����Ӧ���IJ����У����������뻹ԭ��������ʵ����ı���
��3����Ӧ�������ữ��ʱӦѡ���������е����������
a��ϡ����b��ϡ����c��������
��4���������������ǣ�ʵ���ҽ��иò������õ��IJ���������
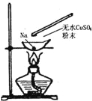
����ijС�������ͼ��ʾ��װ��ͼ��ͼ�мгֺͼ���װ����ȥ�����ֱ��о�SO2��Cl2������

��5��������˷ֱ�ͨ��SO2��Cl2,װ��A�й۲쵽�������Ƿ���ͬ����������ͬ����������ͬ������
��6����װ��B��װ��5.0mL1.0mol/L�ĵ�ˮ����ͨ������Cl2��ȫ��Ӧ��ת����5.0��10-2mol���ӣ��÷�Ӧ�Ļ�ѧ����ʽΪ��
��7������Ԫ��S��O���-2���������X��X��S��O��������Ϊ4��3����Cl2�뺬X����Һ��ȫ��Ӧ����dz��ɫ����������ȡ�����ϲ�����������ữ���Ȼ�����Һ���а�ɫ����������д��Cl2�뺬X����Һ��Ӧ�����ӷ���ʽ��
���𰸡�
��1��SiO2+2KOH===K2SiO3+H2O��ClO3-+6OH-+3MnO2===3MnO42-+3H2O+Cl-
��2��2��1
��3��b
��4���������ձ���©����������
��5����ͬ
��6��5Cl2+I2+6H2O===2HIO3+10HCl
��7��S2O32-+Cl2+H2O===SO42-+S��+2H++2Cl-
��������
�����������1�����ڹ�����Ҫ�����������ڣ�������ԭ�Ϻ���SiO2���ڸ����£����������Ժ�KOH������ӦSiO2+2KOH![]() K2SiO3+H2O����ʴ���������ʲ���ʹ�ô���������ʹ�����������ʴ�Ϊ����������SiO2+2KOH
K2SiO3+H2O����ʴ���������ʲ���ʹ�ô���������ʹ�����������ʴ�Ϊ����������SiO2+2KOH![]() K2SiO3+H2O����Ӧ���Ǽ���Һ�ж������̻�ԭ���������ΪCl-���������̱�����Ϊ����أ���Ӧ�����ӷ���ʽΪ��ClO3-+6OH-+3MnO2=3MnO42-+3H2O+Cl-���ʴ�Ϊ��ClO3-+6OH-+3MnO2=3MnO42-+3H2O+Cl-��
K2SiO3+H2O����Ӧ���Ǽ���Һ�ж������̻�ԭ���������ΪCl-���������̱�����Ϊ����أ���Ӧ�����ӷ���ʽΪ��ClO3-+6OH-+3MnO2=3MnO42-+3H2O+Cl-���ʴ�Ϊ��ClO3-+6OH-+3MnO2=3MnO42-+3H2O+Cl-��
��2��K2MnO4���ᷢ��������ԭ��Ӧ����KMnO4��MnO2��MnԪ�صĻ��ϼ���+6��Ϊ+7��+4�ۣ����KMnO4Ϊ�������MnO2Ϊ��ԭ������ݻ��ϼ�������ȿ�֪�����������뻹ԭ��������ʵ���֮��Ϊ��6-4������7-6��=2��1���ʴ�Ϊ��2��1��
��3�����Ը��������Һ����������������������˲���ѡ�������ữ���ʴ�Ϊ��a��
��4�����̿��к��в�����ˮ�����ʣ�������ͼ��֪��ͨ���������õ���Һ����˲�����Ϊ���ˣ������õ��IJ��������У���������©�����ձ����ʴ�Ϊ�����ˣ��ձ���©������������
��5�����������ܺ���ɫ���ʷ�Ӧ������ɫ���ʣ����Զ���������Ư���ԣ�������ˮ��Ӧ���ɴ����ᣬ���������ǿ�����ԣ���ʹ��ɫ������ɫ������������˷ֱ�ͨ��SO2��Cl2��װ��A�й۲쵽��������ͬ����ʹƷ����ɫ���ʴ�Ϊ����ͬ��
��6����װ��B��װ��5.0mL1.0��10-3mol/L�ĵ�ˮ����ͨ������Cl2��ȫ��Ӧ��ת�Ƶĵ���Ϊ5.0��10-5mol�����Ԫ�������������еĻ��ϼ�Ϊa������ݵ���ת���غ���5.0��10-3L��1.0��10-3mol/L��2��a=5.0��10-5mol�����a=+5�����Եⵥ�ʱ�����ΪHIO3����÷�Ӧ�Ļ�ѧ����ʽΪ��5Cl2+I2+6H2O=2HIO3+10HCl���ʴ�Ϊ��5Cl2+I2+6H2O=2HIO3+10HCl��
��7������Ԫ��S��O���-2���������X��X��S��O��������Ϊ4��3������X��S��O��ԭ�Ӹ�����Ϊ![]() �����Ը�����ΪS2O32-��������ǿ�����ԣ��ܺ������������ӷ���������ԭ��Ӧ����������֪���÷�Ӧ����������������ɣ�dz��ɫ����ΪS�����Ը÷�Ӧ�����ӷ���ʽΪ��Cl2+S2O32-+H2O�T2Cl-+2H++S��+SO42-���ʴ�Ϊ��Cl2+S2O32-+H2O�T2Cl-+2H++S��+SO42-��
�����Ը�����ΪS2O32-��������ǿ�����ԣ��ܺ������������ӷ���������ԭ��Ӧ����������֪���÷�Ӧ����������������ɣ�dz��ɫ����ΪS�����Ը÷�Ӧ�����ӷ���ʽΪ��Cl2+S2O32-+H2O�T2Cl-+2H++S��+SO42-���ʴ�Ϊ��Cl2+S2O32-+H2O�T2Cl-+2H++S��+SO42-��