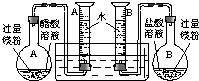
题目内容
某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于______,其改进方法是______.
(2)改进装置后,检查一侧装置的气密性的方法是______.
(3)欲配制100mL实验所需浓度的盐酸,除50mL量筒、烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是______.
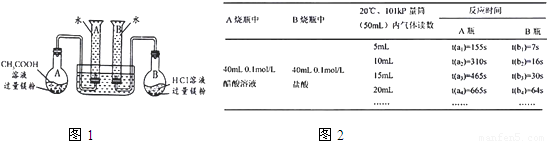
正确操作,记录得到下表中部分实验数据.分析数据,观察实验装置图,回答下列问题:
| A烧瓶中 | B烧瓶中 | 20℃、101kPa 50mL量筒内气体读数 | 反应时间 | |
| A瓶 | B瓶 | |||
| 40mL0.1mol/L 醋酸溶液 | 40mL0.1mol/L 盐酸溶液 | 5mL | t(a1)=155s | t(b1)=7s |
| 10mL | t(a2)=310s | t(b2)=16s | ||
| 15mL | t(a3)=465s | t(b3)=30s | ||
| 20mL | t(a4)=565s | t(b4)=64s | ||
| … | … | … | ||
| 44.8mL | t(an)=865s | t(bn)=464s | ||
②由______[用含t(b1)、t(b2)、t(b3)代数式表示]说明盐酸是可能不存在电离平衡;由______[用含t(a1)、t(a2)、t(a3)代数式表示]说明醋酸中存在电离平衡.
(5)通过该实验可得到的结论是(回答出两点即可):①______;②______.

【答案】分析:(1)根据装置中量筒密封可能导致的事故来回答;
(2)根据气体的热胀冷缩的性质来检验装置的气密性;
(3)配制一定物质的量浓度的溶液所需的仪器:量筒、烧杯、胶头滴管、一定规格的容量瓶以及玻璃棒;
(4)物质的量浓度大小影响化学反应速率进而会影响化学反应的时间;盐酸中随着氢离子的消耗反应速率减慢可以证明其中不存在电离平衡;醋酸中随着氢离子的消耗反应速率没有减慢趋势可以证明其中存在电离平衡;
(5)根据实验现象结合盐酸和醋酸的性质得出结论.
解答:解:(1)在装置中,A、B两个量筒口用胶塞密封,这样反应产生的H2会造成压强过大而发生危险,可以将A、B量筒口的胶塞去掉,
故答案为:A、B两个量筒口用胶塞密封,反应产生的H2会造成压强过大而发生危险[或密封的量筒内气压随反应开始后不断增大,会造成烧瓶或量筒因压强过大将胶塞推出];除去A、B量筒口的胶塞;
(2)装置气密性的检验方法:将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气,
故答案为:将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气;
(3)欲配制100mL实验所需浓度的盐酸,所需的仪器:量筒、烧杯、胶头滴管、一定规格的容量瓶以及玻璃棒,
故答案为:100mL容量瓶、玻璃棒;
(4)①开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+],所以a1的反应速率小于b1,即t(a1)远远大于
t(b1),
故答案为:开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+];
②盐酸中随着氢离子的消耗反应速率减慢可以证明其中不存在电离平衡,即t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2),醋酸中随着氢离子的消耗反应速率没有减慢趋势可以证明其中存在电离平衡,即t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2),
故答案为:t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2);t(a3)-t(a2)=t(a2)-t(a1)
或t(a3)=t(a1)+t(a2);
(5)金属和酸的化学反应速率取决于溶液中氢离子的浓度,相同物质的量浓度的盐酸、醋酸与金属反应时,开始阶段,盐酸中氢离子浓度大,所以盐酸开始反应速率大,过一段时间后,由于醋酸的电离平衡的右移,导致醋酸较盐酸反应速率的快,说明盐酸是强电解质,醋酸是弱电解质(存在电离平衡),
故答案为:相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大,过一段时间后醋酸较盐酸反应速率的快;盐酸是强电解质,醋酸是弱电解质(存在电离平衡).
点评:本题是一道开放性的实验探究题,要求学生具有分析和解决问题的能力,综合性较强,难度较大.
(2)根据气体的热胀冷缩的性质来检验装置的气密性;
(3)配制一定物质的量浓度的溶液所需的仪器:量筒、烧杯、胶头滴管、一定规格的容量瓶以及玻璃棒;
(4)物质的量浓度大小影响化学反应速率进而会影响化学反应的时间;盐酸中随着氢离子的消耗反应速率减慢可以证明其中不存在电离平衡;醋酸中随着氢离子的消耗反应速率没有减慢趋势可以证明其中存在电离平衡;
(5)根据实验现象结合盐酸和醋酸的性质得出结论.
解答:解:(1)在装置中,A、B两个量筒口用胶塞密封,这样反应产生的H2会造成压强过大而发生危险,可以将A、B量筒口的胶塞去掉,
故答案为:A、B两个量筒口用胶塞密封,反应产生的H2会造成压强过大而发生危险[或密封的量筒内气压随反应开始后不断增大,会造成烧瓶或量筒因压强过大将胶塞推出];除去A、B量筒口的胶塞;
(2)装置气密性的检验方法:将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气,
故答案为:将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气;
(3)欲配制100mL实验所需浓度的盐酸,所需的仪器:量筒、烧杯、胶头滴管、一定规格的容量瓶以及玻璃棒,
故答案为:100mL容量瓶、玻璃棒;
(4)①开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+],所以a1的反应速率小于b1,即t(a1)远远大于
t(b1),
故答案为:开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+];
②盐酸中随着氢离子的消耗反应速率减慢可以证明其中不存在电离平衡,即t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2),醋酸中随着氢离子的消耗反应速率没有减慢趋势可以证明其中存在电离平衡,即t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2),
故答案为:t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2);t(a3)-t(a2)=t(a2)-t(a1)
或t(a3)=t(a1)+t(a2);
(5)金属和酸的化学反应速率取决于溶液中氢离子的浓度,相同物质的量浓度的盐酸、醋酸与金属反应时,开始阶段,盐酸中氢离子浓度大,所以盐酸开始反应速率大,过一段时间后,由于醋酸的电离平衡的右移,导致醋酸较盐酸反应速率的快,说明盐酸是强电解质,醋酸是弱电解质(存在电离平衡),
故答案为:相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大,过一段时间后醋酸较盐酸反应速率的快;盐酸是强电解质,醋酸是弱电解质(存在电离平衡).
点评:本题是一道开放性的实验探究题,要求学生具有分析和解决问题的能力,综合性较强,难度较大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁粉反应的速率和电离平衡理论进行研究。设计的实验装置如图(夹持固定装置已略去),正确操作得到如下实验数据。
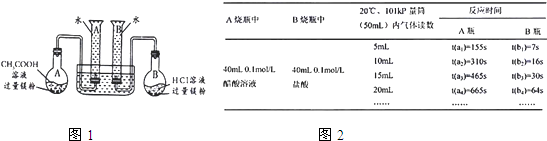
A烧瓶中 | B烧瓶中 | 反应时间 | ||||
A瓶 | B瓶 | |||||
CH3COOH 溶液 0.1 mol/L 40 Ml | 盐酸 0.1 mol/L 40 mL | 5 mL | t(a1)=155 s | t(b1)=7 s | ||
10 mL | t(a2)=310 s | t(b2)=16 s | ||||
15 mL | t(a3)=465 s | t(b3)=30 s | ||||
20 mL | t(a4)=665 s | t(b4)=54 s | ||||
…… | …… | …… | ||||
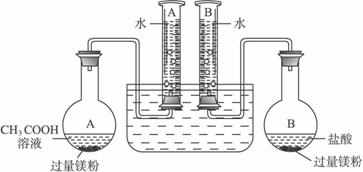
分析数据,观察装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷,根本无法完成实验,甚至存在危险。缺陷在于_____________________________________________________________。
(2)写出B烧瓶中反应的离子方程式:___________________________________________。
(3)欲配制100 mL实验所需浓度的盐酸,除需要烧杯、酸式滴定管之外,还需要用到的主要玻璃仪器是________________________________________________________________。
(4)在实验数据中①t(a1)远远大于t(b1)的原因为:____________________________;
②由__________________________________〔用有关t(a1)、t(a2)、t(a3)的代数式表示〕说明醋酸中存在电离平衡。
(5)该实验能得到什么结论:(最少答出两点)
①___________________________。②___________________________。
 (2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.