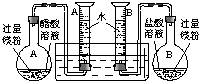
题目内容
某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁粉反应的速率和电离平衡理论进行研究。设计的实验装置如图(夹持固定装置已略去),正确操作得到如下实验数据。A烧瓶中 | B烧瓶中 | 反应时间 | ||||
A瓶 | B瓶 | |||||
CH3COOH 溶液 0.1 mol/L 40 Ml | 盐酸 0.1 mol/L 40 mL | 5 mL | t(a1)=155 s | t(b1)=7 s | ||
10 mL | t(a2)=310 s | t(b2)=16 s | ||||
15 mL | t(a3)=465 s | t(b3)=30 s | ||||
20 mL | t(a4)=665 s | t(b4)=54 s | ||||
…… | …… | …… | ||||

分析数据,观察装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷,根本无法完成实验,甚至存在危险。缺陷在于_____________________________________________________________。
(2)写出B烧瓶中反应的离子方程式:___________________________________________。
(3)欲配制100 mL实验所需浓度的盐酸,除需要烧杯、酸式滴定管之外,还需要用到的主要玻璃仪器是________________________________________________________________。
(4)在实验数据中①t(a1)远远大于t(b1)的原因为:____________________________;
②由__________________________________〔用有关t(a1)、t(a2)、t(a3)的代数式表示〕说明醋酸中存在电离平衡。
(5)该实验能得到什么结论:(最少答出两点)
①___________________________。②___________________________。
(1)量筒口的单孔塞阻碍其中水的排出;去掉单孔塞
(2)Mg+2H+====Mg2++H2↑
(3)100 mL容量瓶、胶头滴管、玻璃棒
(4)①醋酸是弱电解质,等浓度的醋酸与盐酸电离出的c(H+),醋酸小于盐酸
②t(a1)=t(a2)-t(a1)=t(a3)-t(a2).
(5)①镁粉与酸反应的速率主要决定于溶液中的c(H+)的大小
②盐酸随反应进行,c(H+)会迅速降低,反应速率也迅速降低
③醋酸是弱电解质,在溶液中存在电离平衡,随反应进行,醋酸的电离平衡右移,使c(H+)不会迅速降低,反应速率也不会迅速降低
解析:(3)按照操作步骤逐一分析用到的仪器,可知还需要的玻璃仪器有:100 mL容量瓶、胶头滴管、玻璃棒。(4)HCl====H++Cl-,CH3COOH![]() CH3COO-+H+,醋酸中c(H+)小于盐酸中c(H+),导致均产生5 mL H2时t(a1)远远大于t(b1)。反应至465s以前,A瓶中气体每增加5 mL所用时间都增加155s,可知A瓶中c(H+)减小很慢,则说明CH3COOH存在电离平衡。(4)在对比A、B两瓶中存在的作用和反应的基础上,结合A、B两瓶中实验现象的差异分析可得出结论t(a1)与t(b1)相差较大,从醋酸是弱电解质解释;t(a1)与t(a2)、t(a3)的关系表中数据可推出t(a1)=t(a2)-t(a1)=t(a3)-t(a2);(5)的解释Mg与酸反应速率由c(H+)大小决定,盐酸反应c(H+)降低快,醋酸溶液c(H+)降低慢,三点中答两点即可。
CH3COO-+H+,醋酸中c(H+)小于盐酸中c(H+),导致均产生5 mL H2时t(a1)远远大于t(b1)。反应至465s以前,A瓶中气体每增加5 mL所用时间都增加155s,可知A瓶中c(H+)减小很慢,则说明CH3COOH存在电离平衡。(4)在对比A、B两瓶中存在的作用和反应的基础上,结合A、B两瓶中实验现象的差异分析可得出结论t(a1)与t(b1)相差较大,从醋酸是弱电解质解释;t(a1)与t(a2)、t(a3)的关系表中数据可推出t(a1)=t(a2)-t(a1)=t(a3)-t(a2);(5)的解释Mg与酸反应速率由c(H+)大小决定,盐酸反应c(H+)降低快,醋酸溶液c(H+)降低慢,三点中答两点即可。

 名校课堂系列答案
名校课堂系列答案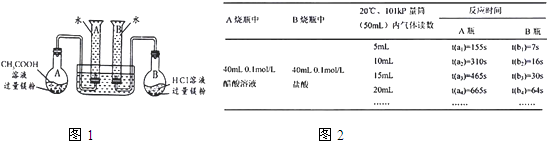
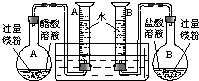 (2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.