题目内容
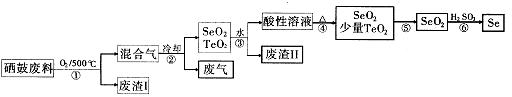
(14分)硒34Se和碲52Te都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上用硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:
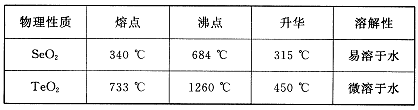
已知:
(1)Se的氢化物的电子式是____。
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是 。
(3)废气的主要成分是____ ;废渣II的主要成分是 。
(4)步骤④中主要反应的化学方程式是 ;步骤⑥反应的化学方程式是 。
(5)根据表中数据,步骤⑤最适宜的分离方法是 。

已知:

(1)Se的氢化物的电子式是____。
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是 。
(3)废气的主要成分是____ ;废渣II的主要成分是 。
(4)步骤④中主要反应的化学方程式是 ;步骤⑥反应的化学方程式是 。
(5)根据表中数据,步骤⑤最适宜的分离方法是 。
(14分)
(1)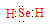
(2)增大接触面积,加快反应速率,使废料充分燃烧
(3)CO2 TeO2
(4)H2SeO3 SeO2+ H2O 2H2SO3+SeO2=Se+2H2SO4
SeO2+ H2O 2H2SO3+SeO2=Se+2H2SO4
(5)升华,将温度控制在315°C到450°C之间
(1)
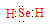
(2)增大接触面积,加快反应速率,使废料充分燃烧
(3)CO2 TeO2
(4)H2SeO3
 SeO2+ H2O 2H2SO3+SeO2=Se+2H2SO4
SeO2+ H2O 2H2SO3+SeO2=Se+2H2SO4(5)升华,将温度控制在315°C到450°C之间
试题分析:(1)Se是第六主族元素,氢化物的化学式与H2O相似,属于共价化合物,电子式为
 ;
;(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是增大接触面积,加快反应速率,使废料充分燃烧
(3)根据硒鼓废料的成分判断,废气是CO2;SeO2易溶于水,TeO2微溶于水,所以废渣主要是TeO2;
(4)SeO2溶于水生成H2SeO3,受热分解生成SeO2,化学方程式为H2SeO3
 SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4(5)根据SeO2和TeO2升华的温度,二者分离的最适宜方法是升华。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

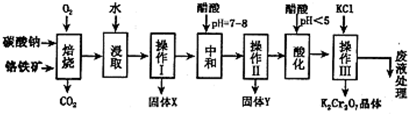
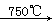 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑; 2CrO42-+2H+
2CrO42-+2H+