题目内容
【题目】已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用.请回答下列问题:

(1)该“84 消毒液”的物质的量浓度约为__mol/L.( 保留小数点后 1 位)
(2)该同学参阅此“84 消毒液”的配方,欲用NaClO固体配制480mL 与市售物质的量浓度相同的“84 消毒液”,下列说法中正确的是__( 填序号).
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g

(3)“84 消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用 98%( 密度为1.84g/cm3)的浓硫酸配制 500mL 2.3mol/L 的稀硫酸用于增强“84 消毒液”的消毒能力.
①需用浓硫酸的体积为__mL.
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是__。
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液的质量 D.溶液的密度
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于2.3mol/L有__。
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面.
【答案】 4.0 C 62.5 BD AD
【解析】试题(1)c(NaClO)=c=![]() =
=![]() =4.0molL-1,故答案为:4.0;
=4.0molL-1,故答案为:4.0;
(2)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、不需要,但还需玻璃棒和胶头滴管,故A错误;B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;D.应选取500mL的容量瓶进行配制,然后取出480mL即可,所以需要NaClO的质量:0.5L×4.0molL-1×74.5gmol-1=149g,故D错误;故答案为:C;
(3)①溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=![]() =18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=0.5L×2.3mol/L,V=0.625L=62.5mL,故答案为:62.5;
=18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=0.5L×2.3mol/L,V=0.625L=62.5mL,故答案为:62.5;
②A.溶液中H2SO4的物质的量n=cV,与体积有关,错误;B.溶液具有均一性,溶液的浓度与体积无关,正确;C.溶液的质量m=ρV,与体积有关,错误;D.溶液具有均一性,溶液的密度与体积无关,正确;故选BD;
③A.未经冷却趁热将溶液注入容量瓶中,导致溶液体积偏小,浓度偏大,正确;B.摇匀后发现液面低于刻度线,再加水至刻度线,导致溶液体积偏大,浓度偏小,错误;C.容量瓶中原有少量蒸馏水对结果无影响,错误;D.定容时俯视观察液面,导致溶液体积偏小,浓度偏大,正确;故选AD。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案【题目】锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一,早在远古时代,人们便发现并使用了锡。回答下列问题:
(1)锡是50号元素,在元素周期表中位于________区。
(2)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子的空间构型为________。
(3)比较下列卤化锡的熔点和沸点,分析其变化规律及原因____________________________________
SnCl4 | SnBr4 | SnI4 | |
熔点/℃ | -33 | 31 | 144.5 |
沸点/℃ | 114.1 | 202 | 364 |
(4)汽车废气中常含有有毒的一氧化碳气体,但在二氧化锡的催化下,在300 ℃时,一氧化碳可大部分转化为二氧化碳。C、O、Sn电负性由大至小的顺序是__________________________________________。
(5)灰锡具有金刚石型结构,其中Sn原子的杂化方式为________,微粒之间存在的作用力是__________________________________。
(6)①原子坐标参数,表示晶胞内部各原子的相对位置,如图为灰锡的晶胞,其中原子坐标参数A为(0,0,0),B为(1/2,0/1/2),则D为(1/4,___ ,___ )。锡的配位数为________。
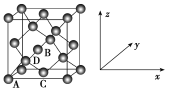
②已知灰锡的晶胞参数a=0.648 9 nm,其密度为______ g·cm-3(NA为6.02×1023 mol-1,不必算出结果,写出简化后的计算式即可)。