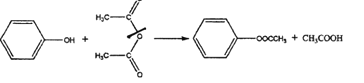
题目内容
【题目】下列说法正确的是( )
A. 3O2(g) == 2O3(g) ΔH>0,则可判定O2(g)比O3(g)稳定
B. 由1 mol H2形成2 mol H要放出热量
C. 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-2Q kJ/mol
2NH3(g) ΔH=-2Q kJ/mol
D. 已知Ni(CO)4(g)=Ni(s)+4CO(g) ΔH=Q kJ/mol(Q>0),则Ni(s)+4CO(g)=Ni(CO)4(g) ΔH=-Q kJ/mol
【答案】AD
【解析】
A、该反应为吸热反应,氧气的能量低于O3的能量,能量越低,物质越稳定,O2比O3稳定,故A说法正确;
B、1molH2形成2molH,这是断键,断键吸收能量,不是放出能量,故B说法错误;
C、N2和H2反应是可逆反应,题中无法得出消耗N2、消耗H2或者生成NH3的物质的量,即无法求出合成氨的△H,故C说法错误;
D、状态不变时,正反应为吸热反应,逆反应为放热反应,故D说法正确。

 每课必练系列答案
每课必练系列答案【题目】二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用。回答下列问题:
I.实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3)。
(1)盐酸和NaClO3反应时有ClO2和Cl2生成,书写反应的离子方程式并标出电子转移的方向和数目______________________________________,当反应中转移0.2mol电子时,参加反应的还原剂的物质的量为________________________________。
(2)使用双氧水作还原剂的优点是_________________________________________。
II.当pH≤2.0时,NaClO2能被I 完全还原成Cl;(离子反应方程式为ClO2+4H++4I→2I2+Cl+2H2O)。回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6(2Na2S2O3+I2→2NaI+Na2S4O6)。欲测定成品中NaClO2的含量,现进行如下操作:
步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定发生反应 |
(1)步骤Ⅱ加入指示剂的名称是_______________。滴定终点时溶液的颜色变化为_________。
(2)若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为__________(用含W、c、V的代数式表示)。
(3)ClO2和Cl2均能将电镀废水中的CN 氧化为无毒的物质,自身被还原为Cl,处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的___倍。
【题目】探究Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶 | 0.1molLNa2S2O3 溶液/mL | 蒸馏水 | 0.2mol/L H2SO4 溶液 | 反应温度 | 浑浊出现时间/s | 备注 |
1 | 10 | 0 | 10 | 20℃ | 10 | |
2 | 10 | 5 | 5 | 20℃ | 16 | |
3 | 10 | 0 | 10 | 50℃ | 5 | 第10 秒开始浑浊不再增多 |
4 | 10 | 6 | 4 | 50℃ | 8 |
A. 该反应也可通过测SO2的体积变化来表示化学反应速率的快慢
B. 3号瓶用Na2S2O3 来表示速率为0.0lmol/(Ls)
C. 由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D. 由1号瓶和4号瓶实验结果可得温度越高反应速率越快