题目内容
【题目】短周期元素形成的纯净物A、B、C、D、E,五种物质之间的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同).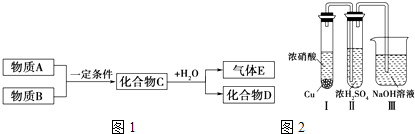
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,则C的化学式 , 并任写一种C的主要用途 .
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物.
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因(仅写出电离方程式即可): .
②用电荷守恒的等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系: .
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 .
②已知常温下物质A与物质B反应生成1mol气体C的△H=﹣57kJmol﹣1 , 1mol气体C与H2O反应生成化合物D和气体E的△H=﹣46kJmol﹣1 , 写出物质A与物质B及水反应生成化合物D的热化学方程式为 .
③有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图2所示装置进行实验.
实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是 .
④用铂做电极电解H2SO4的溶液,其阳极的电极反应式为 .
【答案】
(1)Na2O2;供氧剂、漂白剂、氧化剂
(2)H++H2O+AlO2﹣?Al(OH)3?Al3++3OH﹣;c(Na+)+c(H+)═2c(S2﹣)+c(HS﹣)+c(OH﹣)
(3)3NO2+H2O═2HNO3+NO;4NO(g)+3O2(g)+2H2O(1)=4HNO3 (aq)△H=﹣618kJ?mol﹣1;NO2能溶于浓H2SO4 , 因而不能用浓H2SO4干燥NO2;4OH﹣﹣4e﹣═O2↑+2H2O
【解析】解:(1)若C是离子化合物,D是一种强碱,C为Na2O2 , D为NaOH,E为O2 , A、B分别为氧气、Na中的一种,过氧化钠可以用作供氧剂、漂白剂、氧化剂等,所以答案是:Na2O2;供氧剂、漂白剂、氧化剂;
(2.)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物,C为Al2S3 , E为H2S,D为Al(OH)3 , A、B分别为Al、S中的一种,则:①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因:H++H2O+AlO2﹣═Al(OH)3═Al3++3OH﹣ , 所以答案是:H++H2O+AlO2﹣Al(OH)3Al3++3OH﹣;②H2S与NaOH溶液反应生成正盐为Na2S,溶液中硫离子水解,用电荷守恒的等式表示溶液中所有离子的浓度之间的关系为:c(Na+)+c(H+)═2c(S2﹣)+c(HS﹣)+c(OH﹣),所以答案是:c(Na+)+c(H+)═2c(S2﹣)+c(HS﹣)+c(OH﹣);
(3)若C是一种气体,D是一种强酸,C为NO2 , D为HNO3 , E为NO,则:①C与水反应的化学方程式为:3NO2+H2O═2HNO3+NO,
所以答案是:3NO2+H2O═2HNO3+NO;②常温下物质A与物质B生成1mol气体C的△H为﹣57kJmol﹣1 , 则:反应的热化学方程式为:①2NO(g)+O2(g)=2NO2(g)△H=﹣114kJmol﹣1 , 1mol气体C与H2O反应生成D溶液和E气体的△H为﹣46kJmol﹣1 , 反应的热化学方程式为:②3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=﹣138 kJmol﹣1 , 则①×3+②×2得4NO(g)+3O2(g)+2H2O(1)=4HNO3 (aq);△H=3×(114kJmol﹣1)+2×(﹣138 kJmol﹣1)=﹣618kJmol﹣1 , 所以答案是:4NO(g)+3O2(g)+2H2O(1)=4HNO3 (aq)△H=﹣618kJmol﹣1;③由现象实验过程中,浓H2SO4中未发现有气体逸出,可以得出NO2能溶于浓硫酸中,所以答案是:NO2能溶于浓H2SO4 , 因而不能用浓H2SO4干燥NO2;④用铂做电极电解H2SO4的溶液,阳极发生氧化反应,氢氧根离子在阳极放电生成氧气,其阳极的电极反应式为:4OH﹣﹣4e﹣═O2↑+2H2O,所以答案是:4OH﹣﹣4e﹣═O2↑+2H2O.