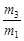题目内容
某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A===H++HA-HA- H++A2-回答下列问题:
H++A2-回答下列问题:
(1)Na2A溶液显____(填“酸性”、“中性”或“碱性”),理由是:______(用离子方程式或必要的文字说明)。
(2)常温下,已知0.1 mol·L-1 NaHA溶液pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能_______0.11 mol·L-1(填“大于”、“等于”或“小于”),理由是______。
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是_______ ___。
 H++A2-回答下列问题:
H++A2-回答下列问题:(1)Na2A溶液显____(填“酸性”、“中性”或“碱性”),理由是:______(用离子方程式或必要的文字说明)。
(2)常温下,已知0.1 mol·L-1 NaHA溶液pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能_______0.11 mol·L-1(填“大于”、“等于”或“小于”),理由是______。
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是_______ ___。
(1)碱 Na2A中A2-水解使溶液中c(OH-)>c(H+),A2-+H2O HA-+OH-
HA-+OH-
(2)< H2A第一步电离的c(H+)=0.1 mol·L-1且对HA-的电离有抑制作用,使H2A第二步电离出的c(H+)<0.01 mol·L-1 (3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
 HA-+OH-
HA-+OH-(2)< H2A第一步电离的c(H+)=0.1 mol·L-1且对HA-的电离有抑制作用,使H2A第二步电离出的c(H+)<0.01 mol·L-1 (3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
试题分析:(1)根据H2A的电离可知,H2A的第一步电离是完全的,但第二步电离是不完全的,所以Na2A溶于水,A2-水解,溶液显碱性,水解原理是:H2O+A2-
 HA-+OH-。
HA-+OH-。(2)0.1mol/L的H2A溶液中第一步电离出的氢离子浓度是0.1mol/L。由于第一步电离出的氢离子会抑制HA-的电离,所以溶液中氢离子的物质的量浓度小于0.11mol/L。
(3)HA-在溶液中只有电离平衡,溶液显酸性,则溶液中各种离子浓度由大到小的顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
点评:该题是中等难度的试题,试题贴近高考,紧扣教材基础知识,旨在培养学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生的逻辑推理能力和创新思维能力。该题的关键是注意H2A的电离特点,然后结合题意灵活运用即可。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
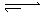 mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据: