题目内容
(共10分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出元素N的基态原子电子排布式 。
(2)D的氢化物易溶于水的原因
(3)D和E的电负性的大小: > (用元素符号表示)
(4)由A、C、D形成的ACD分子中,含有 个σ键, 个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
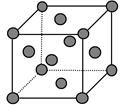
①与M同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有 __________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为 。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
| A | | | |||||||||||||||
| B | | | | C | D | E | F | | |||||||||
| G | H | I | J | | K | L | | ||||||||||
| | | | | | M | | N | | | | | | | | | | |
(1)请写出元素N的基态原子电子排布式 。
(2)D的氢化物易溶于水的原因
(3)D和E的电负性的大小: > (用元素符号表示)
(4)由A、C、D形成的ACD分子中,含有 个σ键, 个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有 __________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为 。

②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
(1)1s22s22p63s23p63d64s2
(2)NH3为极性分子, 与水形成氢键且与水反应 (答出任意两点可得满分)
(3)O N (4) 2 2 (各1分,共2分)
(5)① K、Cu 4 ② 非极性 ③ ①③ 直线形
(2)NH3为极性分子, 与水形成氢键且与水反应 (答出任意两点可得满分)
(3)O N (4) 2 2 (各1分,共2分)
(5)① K、Cu 4 ② 非极性 ③ ①③ 直线形
根据元素在周期表中的位置可知,A是H,B是Li,C是碳,D是氮,E是O,F是氟,G是Na,H是Mg,I是铝,J是Si,K是S,L是Cl,M是Cr,N是Fe。
(1)根据构造原理可知元素Fe的基态原子电子排布式1s22s22p63s23p63d64s2。
(2)氨气是极性分子,根据相似相溶原理可知,氨气易溶在极性溶剂水中。且氨气能和水反应,也能和水形成氢键。
(3)非金属性越强,电负性越大,所以氧的电负性大于氮的。
(4)A、C、D形成的ACD分子是HCN,其中氢和碳形成单键,碳和氮形成三键,所以σ键和π键各是2个。
(5)铬原子的最外层电子是4s1,所以根据构造原理可知还有K和Cu;根据晶胞结构示意图可知含有的原子个数是8×1/8+6×1/2=4;CCl4、CS2等是非极性分子,所以根据相似相溶原理可知,该化合物应是非极性分子;①③是平面型结构,杂化方式为sp2,②⑤是四面体,属于sp3杂化,④是直线型,属于sp杂化。
(1)根据构造原理可知元素Fe的基态原子电子排布式1s22s22p63s23p63d64s2。
(2)氨气是极性分子,根据相似相溶原理可知,氨气易溶在极性溶剂水中。且氨气能和水反应,也能和水形成氢键。
(3)非金属性越强,电负性越大,所以氧的电负性大于氮的。
(4)A、C、D形成的ACD分子是HCN,其中氢和碳形成单键,碳和氮形成三键,所以σ键和π键各是2个。
(5)铬原子的最外层电子是4s1,所以根据构造原理可知还有K和Cu;根据晶胞结构示意图可知含有的原子个数是8×1/8+6×1/2=4;CCl4、CS2等是非极性分子,所以根据相似相溶原理可知,该化合物应是非极性分子;①③是平面型结构,杂化方式为sp2,②⑤是四面体,属于sp3杂化,④是直线型,属于sp杂化。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
 主族
主族