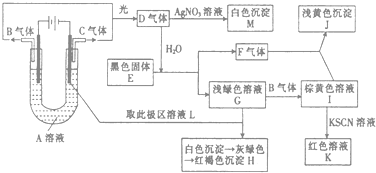
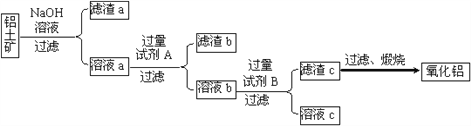
题目内容
【题目】下列判断正确的是
A. 核电荷数:Al < Na B. 金属性:Na > Al
C. 原子序数:Na > Cl D. 原子半径:Cl > Na
【答案】B
【解析】试题分析:A.同一周期的元素,原子序数越大,元素的核电荷数就越大,所以元素的核电荷数:Al > Na,错误;B.同一周期的元素的原子序数越大,元素的金属性就越弱,因此元素的金属性:Na > Al,正确;C.Na是11号元素,Cl是17号元素,所以原子序数:Na< Cl,错误;D.同一周期的元素,原子序数越大,原子半径就越小,所以原子半径:Cl <Na,错误。

练习册系列答案
相关题目
【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g),下列说法正确的是( )
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行