题目内容
【题目】有机物N是一种重要材料的中间体,合成N的一种路线如下:
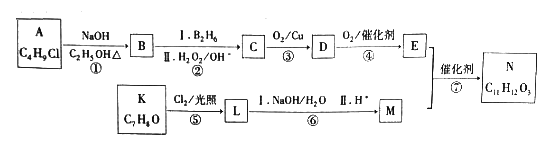
已知:i.一氯代烃A的核磁共振氢谱只有1种峰;
ii.芳香族化合物K遇FeCl3溶液显紫色,其核磁共振氢谱峰面积比为1∶2∶2∶3;
iii.N能发生水解和银镜反应;
iV.RCH=CH2![]() RCH2CH2OH;
RCH2CH2OH;
V.两个羟基连接在同一个碳原子上不稳定,易脱水。
请回答下列问题:
(1)B的结构简式是__________,C的化学名称是_________,D含有的官能团是__________。
(2)步骤①的反应类型是__________。
(3)下列说法不正确的是_________。
a.B和K都能发生氧化反应
b.1molC完全燃烧需6molO2
c.D能与新制氢氧化铜悬浊液反应
d.1molM最多能与3molH2反应
(4)步骤③的化学方程式为_______________________。
(5)步骤⑦的化学方程式为_______________________。
(6)L的同分异构体中苯环上有三个取代基且与L官能团相同的物质共有________种;N经催化氧化得到X(C11H12O4),X的同分异构体中同时满足下列条件的结构简式为___________________。
a.苯环上只有两个取代基,苯环上的一氯代物有2种
b.水解只生成芳香醇和二元酸,且二元酸中有2种不同化学环境的氢
【答案】 (CH3)2C=CH2 2-甲基-1-丙醇 醛基 消去反应 d ![]()
![]() 10
10 ![]()
【解析】一氯代烃A的核磁共振氢谱只有1种峰,则A为(CH3)3CCl。根据流程图, A发生消去反应生成B,B为CH2=C(CH3)2,根据信息iV,B与水加成反应生成醇C,C为(CH3)2CHCH2OH,C氧化生成D,D为(CH3)2CHCHO,D继续氧化生成E,E为(CH3)2CHCOOH。芳香族化合物K遇FeCl3溶液显紫色,其核磁共振氢谱峰面积比为1∶2∶2∶3;则K为![]() ;N能发生水解和银镜反应,说明N中含有酯基和醛基,两个羟基连接在同一个碳原子上不稳定,易脱水,说明M为
;N能发生水解和银镜反应,说明N中含有酯基和醛基,两个羟基连接在同一个碳原子上不稳定,易脱水,说明M为![]() ,N为
,N为![]() 。
。
(1)根据上述分析,B为CH2=C(CH3)2,C为(CH3)2CHCH2OH,名称为2-甲基-1-丙醇,D为(CH3)2CHCHO,含有的官能团有醛基,故答案为:(CH3)2C=CH2;2-甲基-1-丙醇; 醛基;
(2)根据分析,步骤①为卤代烃的消去反应,故答案为:消去反应;
(3)a.B为CH2=C(CH3)2,K为![]() ,都能发生氧化反应,正确;b.C为(CH3)2CHCH2OH,1molC完全燃烧需6molO2,正确;
,都能发生氧化反应,正确;b.C为(CH3)2CHCH2OH,1molC完全燃烧需6molO2,正确;
c.D为(CH3)2CHCHO,含有醛基,能与新制氢氧化铜悬浊液反应,正确;d.M为![]() ,1molM最多能与4molH2反应,错误;故选d;
,1molM最多能与4molH2反应,错误;故选d;
(4)步骤③为(CH3)2CHCH2OH的催化氧化,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)步骤⑦为(CH3)2CHCOOH和![]() 的酯化反应,反应的化学方程式为
的酯化反应,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(6)根据上述分析,L为![]() ,同分异构体中苯环上有三个取代基且与L官能团相同,三个取代基分别为-OH、-Cl和-CH2Cl,当-OH和-Cl处于邻位时,-CH2Cl有4种位置,当-OH和-Cl处于间位时,-CH2Cl有4种位置,当-OH和-Cl处于对位时,-CH2Cl有2种位置,共10种;N经催化氧化得到X(C11H12O4),X的同分异构体中:a.苯环上只有两个取代基,苯环上的一氯代物有2种;b.水解只生成芳香醇和二元酸,且二元酸中有2种不同化学环境的氢,满足条件的结构简式为
,同分异构体中苯环上有三个取代基且与L官能团相同,三个取代基分别为-OH、-Cl和-CH2Cl,当-OH和-Cl处于邻位时,-CH2Cl有4种位置,当-OH和-Cl处于间位时,-CH2Cl有4种位置,当-OH和-Cl处于对位时,-CH2Cl有2种位置,共10种;N经催化氧化得到X(C11H12O4),X的同分异构体中:a.苯环上只有两个取代基,苯环上的一氯代物有2种;b.水解只生成芳香醇和二元酸,且二元酸中有2种不同化学环境的氢,满足条件的结构简式为![]() ,故答案为:10;
,故答案为:10;![]() 。
。

【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”);
