题目内容
12.用46g乙醇与30g乙酸反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是( )| A. | 29.5g | B. | 44g | C. | 74.8g | D. | 88g |
分析 反应的方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,根据乙酸和乙醇的质量关系判断反应的过量问题,结合方程式计算.
解答 解:30g乙酸的物质的量为$\frac{30g}{60g/mol}$=0.5mol,46g乙醇的物质的量为$\frac{46g}{46g/mol}$=1mol,
反应的方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,由此可知乙醇过量,则
CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
1mol 1mol
0.5mol×67% n
n=0.5mol×67%=0.335mol
m(CH3COOCH2CH3)=0.335mol×88g/mol=29.5g,
故选A.
点评 本题考查化学方程式的计算,题目难度不大,注意反应的理论产率的运用以及反应方程式的书写.

练习册系列答案
相关题目
2.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | CO2的水溶液中:c(H+)>c(HCO3-)═2c(CO32-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)十c(OH-) | |
| C. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)═c(I-) | |
| D. | 等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小 |
3.用石墨电极电解足量的CuSO4溶液,欲恢复到电解前CuSO4溶液的浓度,可向电解后的溶液加入一定量的( )
| A. | H2O | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
20.如表为元素周期表的一部分,请参考元素①-⑦在表中的位置,用元素符号或化学用语回答下列问题:
(1)①和②形式的最简有机化合物分子的结构式为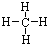
(2)下列事实能证明②的非金属性比⑥强的是CD
A:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;
B:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
C:Na2SiO3+CO2+2H2O═H2SiO3↓+Na2CO3;
D:CH4比SiH4稳定
(3)写出①、③、④三种元素组成化合物的电子式
(4)③、④、⑤的形式的简单离子半径依次减小(填“增大”、“减小”或“不变”)
(5)①、②、⑦三种元素按原子个数之比为11:5:1组成的有机化合物中含有两个-CH3的同分异构体有4种.
| 族 | LA | 0 | ||||||
| 周期 | ||||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||

(2)下列事实能证明②的非金属性比⑥强的是CD
A:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;
B:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
C:Na2SiO3+CO2+2H2O═H2SiO3↓+Na2CO3;
D:CH4比SiH4稳定
(3)写出①、③、④三种元素组成化合物的电子式

(4)③、④、⑤的形式的简单离子半径依次减小(填“增大”、“减小”或“不变”)
(5)①、②、⑦三种元素按原子个数之比为11:5:1组成的有机化合物中含有两个-CH3的同分异构体有4种.
17.下列有关物质变化的说法不正确的是( )
| A. | 煤的液化和气化都是化学变化 | |
| B. | 硝化反应和酯化反应都属于取代反应 | |
| C. | 石油的分馏和裂化都是化学反应 | |
| D. | 乙烯与溴和水的反应都属于加成反应 |
4.下列推断可能合理的是( )
| A. | Cl-、ClO-、Cl2三种微粒只具有氧化性,没有还原性 | |
| B. | Cl2具有强氧化性,可以把水中的氧置换出来 | |
| C. | 因为SO2具有还原性,所以与氯水可以反应生成H2SO4和HCl | |
| D. | Cl2转变为HClO时一定需要加入氧化剂才能实现 |
1.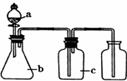 如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( )
如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( )
 如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( )
如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( ) | 选项 | 气体 | a | b | c |
| A | H2 | 稀硫酸 | 锌粒 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | 高锰酸钾 | 浓硫酸 |
| C | C2H2 | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | O2 | 过氧化氢溶液 | 二氧化锰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
16.(1)将0.0lmol下列物质①Na2O2 ②Na2O ③Na2CO3 ④NaCl分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是①=②>③>④(溶液体积变化忽略不计);
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验1条件下平衡常数K=2.67(取小数二位,下同).
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol
(4)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg则该混合物样品中Na2CO3的质量分数是$\frac{31a-84b}{31a}$.
(5)钠一钾合金可在核反应堆中用作热交换液.5.05g钠一钾合金溶于200mL水生成0.075mol氢气,则该溶液中氢氧根离子的物质的量浓度是0.75mol/L(忽略溶液体积变化).
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol
(4)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg则该混合物样品中Na2CO3的质量分数是$\frac{31a-84b}{31a}$.
(5)钠一钾合金可在核反应堆中用作热交换液.5.05g钠一钾合金溶于200mL水生成0.075mol氢气,则该溶液中氢氧根离子的物质的量浓度是0.75mol/L(忽略溶液体积变化).