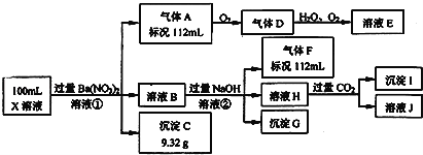
题目内容
【题目】如图为两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )
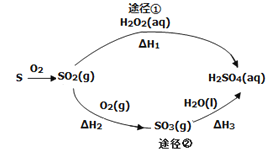
A.途径②增大O2浓度可提高SO2转化率
B.含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C.途径②中SO2和SO3均属于酸性氧化物
D.若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1) +O2 (g)为放热反应
【答案】B
【解析】
试题分析:A、增大一种反应物的浓度可以增大另外一种反应物的转化率,故途径②增大O2浓度可提高SO2转化率,正确;B、中和热是指在稀溶液中强酸与强碱的稀溶液混合生成1mol水放出的热量,含l mol H2SO4的浓溶液与足量NaOH反应生成2mol水,且浓溶液溶于水放热,错误;C、二氧化硫与三氧化硫均属于酸性氧化物,正确;D、若△Hl<△H2+△H3,根据盖斯定律知2H2O2(aq)=2H2O(1) +O2 (g)的H<0,为放热反应,正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目